
| A. | 某溶液中水电离出的c(H+)=10-13,则该溶液的pH一定为13 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的2倍 | |
| C. | pH相同的氨水与盐酸等体积混合,所得溶液pH<7 | |
| D. | pH=7的CH3COOH与CH3COONa混合溶液中,c(Na+)=c(CH3COO-) |
分析 A、由水电离出的c(H+)=10-13的溶液可能为酸性或者碱性溶液;
B、pH相差2,氯离子浓度相差100倍,PH=4.5的番茄汁中c(H+)是PH=6.5的牛奶中c(H+)的100倍;
C、一水合氨为弱电解质,盐酸为强电解质;
D、混合液的pH=7,则:c(OH?)=c(H+).
解答 解:A、某溶液中由水电离出的c(H+)=10-13,该溶液可能为酸溶液或者碱溶液,若为酸溶液,其pH=1,若为碱溶液,其pH=13,故A错误;
B、PH=4.5的番茄汁中c(H+)是PH=6.5的牛奶中c(H+)的100倍,故B错误;
C、一水合氨为弱电解质,盐酸为强电解质,故氨水和盐酸混合后,氨水过量,溶液显碱性,即pH>0,故C错误;
D、混合液的pH=7,则:c(OH?)=c(H+),根据电荷守恒c(CH3COO?)+c(OH?)=c(H+)+c(Na+)可得:c(CH3COO?)=c(Na+),故D正确;
故选D.
点评 本题考查混合液中离子浓度大小比较和pH的有关计算,题目难度中等,根据pH大小确定c(OH?)、c(H+)相对大小,再结合电荷守恒判断即可,试题有利于培养学生的分析、理解能力及灵活应用所学知识的能力.


科目:高中化学 来源: 题型:多选题
| A. | 标准状况下,22.4L四氯化碳的分子数约为NA | |
| B. | 2.4g金属镁变为镁离子时失去的电子数为0.2NA | |
| C. | 16gO2和O3的混合气体中所含的原子数为NA | |
| D. | 1mo1•L-1的A1C13溶液中,C1-离子的数目为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

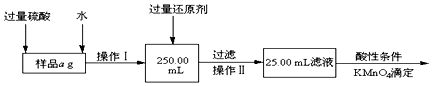
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{b}^{a}R$ | B. | ${\;}_{a-2}^{a+b-2}R$ | C. | ${\;}_{a+2}^{a+b+2}R$ | D. | ${\;}_{a-2}^{a+b}R$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3 | B. | Na2S | C. | (NH4)2CO3 | D. | Na2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 序号 | 反应物 | 产物 |
| ① | Na2O2、MnO4-、H+ | Mn2+、O2、H2O、Na+ |
| ② | Na2O2、H2O | NaOH、O2 |
| ③ | Na2O2、FeSO4 | Na2FeO4 |
| A. | 三组中Na2O2均作氧化剂 | |
| B. | 第②组反应中生成1molO2,转移电子的物质的量为4mol | |
| C. | 第③组反应中产物还有Na2SO4 | |
| D. | 氧化性的强弱顺序为Na2O2>MnO4->FeO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3•H2O溶液的c(OH-)>NaOH溶液的c(OH-) | |
| B. | c(Na+)=c(NH4+) | |
| C. | 等体积的氢氧化钠和氨水溶液分别与足量盐酸完全反应,NaOH消耗的盐酸体积多 | |
| D. | 将pH值相等的氢氧化钠和氨水溶液加水稀释相同倍数,氨水溶液的pH大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com