
| A. | ②⑥⑨ | B. | ①②③④ | C. | ⑥⑦⑧⑨ | D. | ③④⑤⑩ |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①单位时间内生成n mol H2的同时,生成n mol HI,速率之比不等于物质的量之比,故错误;
②一个H-H键断裂等效于两个H-I键形成的同时有两个H-I键断裂,故正确;
③百分组成w(HI)=w(I2),并不是不变,故错误;
④反应速率v(H2)=v(I2)=0.5v(HI),体现正与逆的关系,而速率之比与计量数也不成比例,故错误;
⑤c(HI):c(H2):c(I2)=2:1:1),相等并不是不变,故错误;
⑥温度和体积一定时,生成物浓度不再变化,说明正逆反应速率相等,达平衡状态,故正确;
⑦温度和体积一定时,容器内压强不再变化,容器压强始终不变,故错误;
⑧条件一定,混合气体的平均相对分子质量不再变化,平衡相对分子质量一直不变,故错误;
⑨温度和体积一定时,混合气体的颜色不再变化,说明碘蒸气的浓度不变,达平衡状态,故正确;
⑩温度和压强一定时,混合气体的密度一直不再变化,故错误;故答案为:②⑥⑨,故选A.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| 将打磨过的铝片(过量)放入一定浓度的CuCl2中. | 产生气泡,析出疏松的红色固体,溶液逐渐变为无色 |
| 反应结束后分离出溶液备用 |  |
| 红色固体用蒸馏水洗涤后,置于潮湿空气中 | 一段时间后固体由红色变为绿色[视其主要成分为Cu2(OH)2CO3] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用加热灼烧的方法鉴别铁粉和炭粉 | |
| B. | 用酚酞溶液鉴别未知浓度的NaOH溶液和Na2CO3溶液 | |
| C. | 用丁达尔效应鉴别FeCl2溶液和FeCl3溶液 | |
| D. | 用氨水鉴别MgSO4溶液和Al2(SO4)3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
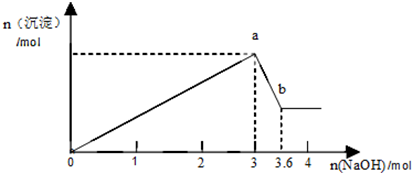
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 推广使用太阳能、风能、海洋能、氢能,有利于缓解温室效应 | |
| B. | 乙醇和汽油都是可再生能源,应大力推广“乙醇汽油” | |
| C. | 用电解水的方法制取大量氢气可以缓解能源不足的问题 | |
| D. | 升高温度活化能降低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
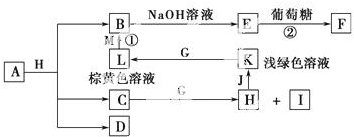
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com