
| A. | 11.2LCl2通入足量氢氧化钠溶液中充分反应,转移的电子数等于0.5NA | |
| B. | 1 mol Al3+完全水解生成氢氧化铝胶体粒子的数目为NA | |
| C. | 常温常压下,32 g O2-中所含电子的数目为17NA | |
| D. | 标准状况下,11.2 L苯中含有分子的数目为0.5 NA |
分析 A、氯气所处的状态不明确;
B、一个氢氧化铝胶粒是多个氢氧化铝的聚集体;
C、求出氧气的物质的量,然后根据1mol氧气中含16mol电子来分析;
D、标况下苯为液态.
解答 解:A、氯气所处的状态不明确,不一定是标况,故物质的量不一定是0.5mol,则转移的电子不一定为0.5NA个,故A错误;
B、一个氢氧化铝胶粒是多个氢氧化铝的聚集体,故生成的氢氧化铝胶粒个数小于NA个,故B错误;
C、32gO2-的物质的量为1mol,而1molO2-中含17mol电子,即17NA个,故C正确;
D、标况下苯为液态,故不能根据气体摩尔体积来计算其物质的量,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:解答题
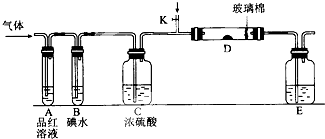 某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究S02和Cl2的性质.
某小组设计如图所示的装置图(图中夹持和加热装置略去),分别研究S02和Cl2的性质.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知如图装置的甲、乙两室内装入液体的体积相同.请回答下列问题:
已知如图装置的甲、乙两室内装入液体的体积相同.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


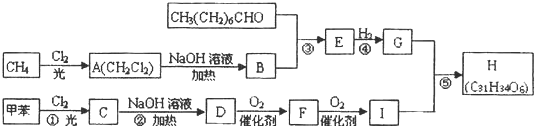
 ,F
,F .
. 、
、 、
、 、
、 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
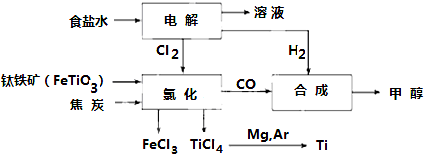
| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c (H+)<c (OH-) | B. | c (HX )<c (X-) | ||
| C. | c (X-)+c(HX )=2c (Na+) | D. | c (X-)-c (HX)═2(c( OH-)-c (H+)) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| c(H+) | c(SO42-) | c(Fe2+、Fe3+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com