
【题目】当光束通过下列分散系时,能观察到丁达尔效应的是( )
A.泥水
B.盐酸
C.NaCl溶液
D.Fe(OH)3胶体
 黄冈天天练口算题卡系列答案
黄冈天天练口算题卡系列答案科目:高中化学 来源: 题型:
【题目】(1)2H2(g)+O2(g)=2H2O(l) ΔH=-484kJ·mol-1 则氢气的燃烧热为 。
(2)C(石墨)![]() C(金刚石)△H>0 则稳定性:石墨 金刚石(填“大于”、“小于”、“等于”)
C(金刚石)△H>0 则稳定性:石墨 金刚石(填“大于”、“小于”、“等于”)
(3)许多运动会使用的火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列题:
①如图是一定量丙烷完全燃烧生成CO2和1molH2O(l)过程中的能量变化图,图中的括号内应填入(“+”或“-”)。
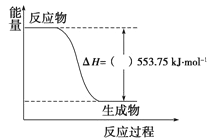
②写出表示丙烷燃烧热的热化学方程式: 。
(4)试运用盖斯定律回答下列问题:
已知:C2H5OH(g)=C2H5OH(l);△H1=-![]() kJ/mol,
kJ/mol,
H2O(g)=H2O(l);△H2=-![]() kJ/mol,
kJ/mol,
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g);△H3=-![]() kJ/mol。
kJ/mol。
若使46g液态无水酒精完全燃烧,并恢复到室温,则整个过程中放出的热量为 KJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施能明显增大原反应的化学反应速率的是( )
A.Na与水反应时增大水的用量
B.将稀H2SO4改为98%的浓H2SO4与Zn反应制取H2
C.在H2SO4与NaOH两溶液反应时,增大压强
D.恒温恒容条件下,在工业合成氨反应中,增加氮气的量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,某溶液由水电离的c(OH-)=1×10-13mol/L,对于该溶液的叙述正确的是( )
A.溶液一定显酸性 B.溶液一定显碱性
C.溶液可能显中性 D.溶液可能是pH=13的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物结构简式为CH3COOCH2-CH=CH-COOH,则该有机物的性质可能有( )
① 加成反应 ② 水解反应 ③ 酯化反应 ④ 中和反应 ⑤ 氧化反应 ⑥ 取代反应
A. 只有①③⑥ B. 只有①③④
C. 只有①③④⑤ D. ①②③④⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原滴定实验与中和滴定类似,是用已知浓度的氧化剂溶液滴定未知浓度的还原剂溶液或反之。现用0. 00lmol/L酸性KMnO4溶液滴定未知浓度的NaHSO3溶液,请回答下列问题:
(1)完成滴定的离子方程式(在__中填系数,在___上填物质或离子):_____
____MnO4-+____HSO3-+____=____Mn2++___ ____+___H2O
(2)该滴定实验的仪器除了铁架台、滴定管夹外,还需要下列用品中的_____(填序号)
A.酸式滴定管 B.碱式滴定管 C.漏斗 D.锥形瓶 E.烧杯 F.白纸
(3) KMnO4溶液不能用____(酸、碱)式滴定管盛装,原因是:_______。
(4)是否需要选择指示剂?_____。滴定终点的现象是___________。
(5)滴定前平视KMnO4液面,刻度为amL,滴定后俯视液面刎度为bmL,则(b-a)mL比实际消耗KMnO4溶液体积_______(填“大”、“小”或“无影响”,下同)。根据(b-a) mL计算,得到NaHSO3的浓度比实际的浓度_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁电池是一种可充电电池,其设计图如下所示:负极材料是Zn,氧化产物是Zn(OH)2,正极材料是K2FeO4(易溶盐),还原产物是Fe(OH)3,电解质溶液是KOH水溶液。下列有关说法正确的是
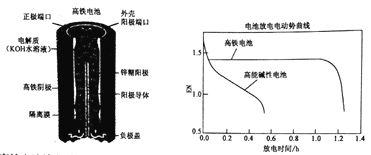
A. 高铁电池放电时正极反应为:Zn+2OH--2e-=Zn(OH)2
B. 高铁电池充电时阴极反应为Fe(OH)3+5OH--3e-=FeO42-+4H2O
C. 高铁电池放电时的总反应为:2FeO42-+8H2O+3Zn=2 Fe(OH)3+3 Zn(OH)2+4OH-
D. 高能碱性电池比高铁电池工作电压更稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸与高锰酸钾在酸性条件下能够发生反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)。甲、乙两个实验小组分别利用酸性KMnO4溶液和H2C2O4溶液的反应来研究外界因素对反应速率的影响。
【实验设计】
甲组方案:通过测定生成CO2气体体积的方法来比较反应速率的大小。实验装置如图所示,25℃时将装置中的A溶液一次性加入B溶液(均已加入等量硫酸酸化)中。
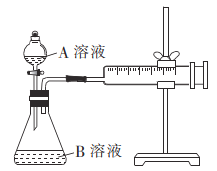
实验编号 | A溶液 | B溶液 |
① | 2 mL 0. 1 mol/LH2C2O4溶液 | 4mL0.0l mol/L酸性KMnO4溶液 |
② | 2 mL 0. 2 mol/LH2C2O4溶液 | 4mL0.0l mol/L酸性KMnO4溶液 |
(1)该反应中氧化剂和还原剂的物质的量之比为________。
(2)该实验探究的是_______对反应速率的影响。实现该实验目的还欠缺的仪器:_______。比较①、②两组化学反应速率大小的方法是____________。
乙组方案:用4mL0.0l mol/L酸性KMnO4溶液与2 mL 0. 01 mol/LH2C2O4溶液,研究不同条件对化学反应速率的影响。具体实验如下:
实验编号 | 10%硫酸的体积/mL | 温度/℃ | 其他物质 |
Ⅰ | 2 | 20 | — |
Ⅱ | 2 | 20 | 少量MnSO4粉末 |
Ⅲ | 2 | 30 | — |
Ⅳ | 1 | 20 | 1mL蒸馏水 |
(3)若要研究催化剂对化学反应速率的影响,则应对比实验
若要研究温度对化学反应速率的影响,则应对比实验________。
(4)对比实验I和实验Ⅳ,可以研究硫酸的浓度对化学反应速率的影响,实验Ⅳ中加入1 mL蒸馏水的目的是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】a、b、c为短周期元素,在周期表中所处位置如右图所示。a、c两元素的原子核外电子数之和等于b原子的质子数。b原子核内质子数和中子数相等。则下列说法正确的是
![]()
A. a的气态氢化物的水溶液呈酸性 B. c的气态氢化物的稳定性最强
C. b的氧化物的水化物是强酸 D. 三种元素的原子半径c最大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com