
| A. | 氧化物:CuO、NO、SO2、H2O | |
| B. | 碱:NaOH、KOH、Ba(OH)2、Na2CO3 | |
| C. | 碱性氧化物:Na2O、CaO、Al2O3、Na2O2 | |
| D. | 电解质:KNO3、Cl2、HCl、BaSO4 |
分析 A、氧化物是负价氧和另外一个化学元素组成的二元化合物;
B、在水溶液里电离出的阴离子全部是氢氧根离子的化合物是碱;
C、凡能跟酸起反应,生成盐和水的氧化物,叫做碱性氧化物;
D、电解质是在水溶液和熔融状态下能导电的化合物.
解答 解:A、氧化物是负价氧和另外一个化学元素组成的二元化合物,CO2、NO、SO2、H2O中氧元素都是负价氧,且都是二元化合物,所以都是氧化物,故A正确;
B、纯碱是碳酸钠,在水中电离出的阴离子是碳酸根离子不是氢氧根离子,所以是盐不是碱,故B错误;
C、Na2O、CaO是能和酸反应生成盐和水的氧化物,所以是碱性氧化物,Al2O3属于两性氧化物,Na2O2和酸反应还会生成盐和水以及氧气,不是碱性氧化物,故C错误;
D、氯气是单质不是化合物的范畴,不属于电解质,故D错误.
故选A.
点评 本题考查了碱性氧化物、电解质、氧化物、碱等概念的判断,难度不大,注意知识的归纳和梳理和关键.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
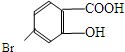 ,它的含氧官能团名称为羧基、羟基.
,它的含氧官能团名称为羧基、羟基.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
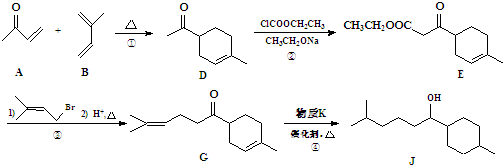
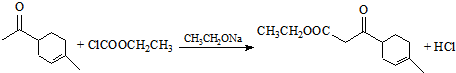
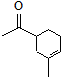 .
.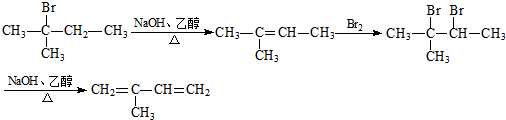 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10 | B. | 8 | C. | 6 | D. | 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
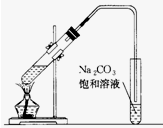 如图是实验室制乙酸乙酯的装置.在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合,然后轻轻地振荡试管,使之混合均匀.
如图是实验室制乙酸乙酯的装置.在大试管中配制一定比例的乙醇、乙酸和浓硫酸的混合,然后轻轻地振荡试管,使之混合均匀.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 化学小组采用类似制乙酸乙酯的装置(如图),用环己醇制备环己烯.
化学小组采用类似制乙酸乙酯的装置(如图),用环己醇制备环己烯.
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 难溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 碱 | 盐 | 氧化物 | |
| A | 硫 酸 | 纯 碱 | 硫酸钡 | 水 |
| B | 氢硫酸 | 烧 碱 | 纯 碱 | 石灰石 |
| C | 碳 酸 | 熟石灰 | 小苏打 | 二氧化硫 |
| D | 二氧化碳 | 苛性钾 | 食 盐 | 石灰石 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com