
【题目】苯乙烯是重要的化工原料。下列有关苯乙烯的说法错误的是
A. 与液溴混合后加入铁粉可发生取代反应
B. 与氯化氢反应可以生成氯代苯乙烯
C. 能使酸性高锰酸钾溶液褪色
D. 在催化剂存在下可以制得聚苯乙烯
【答案】B
【解析】
苯乙烯结构简式为![]() ,
,
A.苯环能和液溴在溴化铁作催化剂条件下发生取代反应;
B.该物质在一定条件下能与HCl发生加成反应而不是取代反应;
C.碳碳双键能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色;
D.碳碳双键在一定条件下能发生加聚反应。
苯乙烯结构简式为![]() ,
,
A.根据结构可知:苯乙烯中含有苯环,苯环能和液溴在溴化铁作催化剂条件下发生苯环上取代反应,选项A正确;
B.该物质分子中含碳碳双键,在一定条件下能与HCl发生加成反应,生成1-氯苯乙烷、2-氯苯乙烷,而不是发生取代反应,选项B错误;
C.物质分子结构中含有碳碳双键,碳碳双键能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,选项C正确;
D.碳碳双键在一定条件下能发生加聚反应,生成聚苯乙烯,选项D正确;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】工业氧化铍可生产金属铍、制作铍合金及特殊陶瓷。由绿柱石(含3BeO·Al2O3·6SiO2及铁等微量元素)和方解石(主要成分是CaCO3)为原料生产氧化铍的工艺流程如下:

已知:Be与Al性质相似。下列叙述错误的是
A. “浸渣”受热后的主要成分是SiO2和CaSO4
B. 利用“碱溶渣”可回收金属铁
C. “水解,调节pH”反应的主要离子是BeO22-
D. 上述流程中“碱、水”宜使用廉价的氨水,降低生产成本
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用碳酸钠晶体(Na2CO310H2O)配制 0.1mol/L 的碳酸钠溶液,正确的方法是
A. 称量 10.6g 碳酸钠晶体,溶解在 1L 水中
B. 称量 28.6g 碳酸钠晶体,溶解在 1L 水中
C. 称量 14.3g 碳酸钠晶体,溶解在适量水中,然后在容量瓶中加水到 1L
D. 称量 14.3g 碳酸钠晶体,溶解在适量水中,然后在容量瓶中加水到 500mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄糖酸亚铁((C6H11O7)2Fe)是常用的补铁剂,易溶于水,几乎不溶于乙醇。用下图装置制备FeCO3,并利用FeCO3与葡萄糖酸反应可得葡萄糖酸亚铁。回答下列问题:
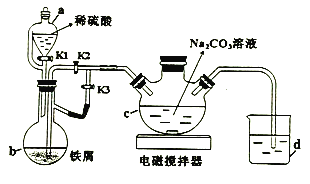
(1)a的名称为_________。
(2)打开a中K1、K3,关闭K2,一段时间后,关闭K3,打开K2。在_________(填仪器标号)中制得碳酸亚铁。实验过程中产生的H2作用有_________、____________。(写2条)
(3)将制得的碳酸亚铁浊液过滤、洗涤。如过滤时间过长会发现产品部分变为红褐色。用化学方程式说明原因____________。
(4)将葡萄糖酸与碳酸亚铁混合,加入乙醇、过滤、洗涤、干燥。加入乙醇的目的是_________________。
(5)用 NaHCO3溶液代替Na2CO3溶液制备碳酸亚铁,同时有气体产生,离子方程式为______________,此法产品纯度更高,原因是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研小组公司开发了Li-SO2Cl2军用电池,其示意图如图所示,已知电池反应为:2Li+SO2Cl2=2LiCl+SO2↑。下列叙述中错误的是

A. 电池工作时负极材料是Li,发生氧化反应
B. 将电解质溶液改为LiCl的水溶液,电池性能会更好
C. 电池工作时电子流向:锂电极→导线→负载→碳棒
D. 电池工作过程中,石墨电极反应式为SO2Cl2+2e=2Cl+SO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3·BH3)作为一种非常有前景的储氢材料,近年来日益受到人们的重视。氨硼烷(NH3·BH3)电池可在常温下工作,装置如下图所示。该电池的总反应为:NH3·BH3+3H2O2=NH4BO2+4H2O。下列说法正确的是( )

A. 右侧电极发生氧化反应 B. 电池工作时,H+通过质子交换膜向左侧移动
C. 负极的电极反应式为H2O2+2H++2e-=2H2O D. 每消耗31g氨硼烷,理论上应转移6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2、CO、CO2、NOx是对环境影响较大的几种气体,对它们的合理控制和治理是优化我们生存环境的有效途径.

(1)利用电化学原理将CO、SO2转化为重要化工原料,装置如图1所示:
①若A为CO,B为H2,C为CH3OH,则通入CO的为_________极(填“正”或“负”)。
②若A为SO2,B为O2,C为H2SO4,则负极的电极反应式为:___________________________。
(2)碳酸盐燃料电池,以一定比例Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,以煤气(CO、H2的体积比为1∶1)直接做燃料,其工作原理如图2所示。
①电池总反应为____________________________________________。
②以此电源电解足量的硝酸银溶液,若阴极产物的质量为21.6g,电解后溶液体积为2L,溶液的pH约为___________。
(3)某研究小组利用下列装置用N2O4生产新型硝化剂N2O5。

①现以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备N2O5,装置如图所示,其中Y为CO2。在该电极上同时还引入CO2的目的是__________________________。
②电解过程中,生成N2O5的电极反应方程式为_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com