
【题目】某校化学小组学生利用如图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl36H2O晶体。(图中夹持及尾气处理装置均已略去)
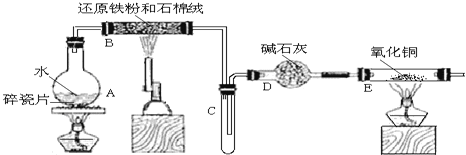
(1)装置B中发生反应的化学方程式是______。
(2)装置E中的现象是______。
(3)停止反应,待B管冷却后,取其中的固体,加入过量稀盐酸充分反应,过滤。写出可能发生的有关反应化学方程式:______。
(4)该小组学生利用上述滤液制取FeCl36H2O晶体,设计流程如图所示:
![]()
①步骤I中通入Cl2的作用是________。
②简述检验滤液中Fe3+的操作方法_______。
③步骤Ⅱ从FeCl3稀溶液中得到FeCl36H2O晶体的主要操作包括:_______。
【答案】3Fe+4H2O(g)![]() Fe3O4+4H2黑色的粉末变成紫红色,管壁产生水珠Fe3O4+8HCl=FeCl2+2FeCl3+4H2O、Fe+2HCl=FeCl2+H2↑、Fe+2FeCl3=3FeCl2将Fe2+氧化成Fe3+取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色加热浓缩、冷却结晶、过滤
Fe3O4+4H2黑色的粉末变成紫红色,管壁产生水珠Fe3O4+8HCl=FeCl2+2FeCl3+4H2O、Fe+2HCl=FeCl2+H2↑、Fe+2FeCl3=3FeCl2将Fe2+氧化成Fe3+取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色加热浓缩、冷却结晶、过滤
【解析】
A中圆度烧瓶在加热条件下可提供水蒸气,B在加热条件下,铁与水蒸气反应生成四氧化三铁和氢气,氢气经干燥,在C中用向下排空法可收集到氢气,D为干燥装置,在加热条件下氢气与氧化铜反应生成铜和水,据此解答该题。
(1)装置B中铁粉与水蒸气在高温下发生反应生成四氧化三铁和氢气,反应的化学方程式为3Fe+4H2O(g)![]() Fe3O4+4H2;
Fe3O4+4H2;
(2)装置B中铁与水蒸气反应生成的氢气,经碱石灰干燥后加入装置E,氧化铜与氢气加热发生反应生成了铜和水,所以反应的现象为:黑色的粉末变成紫红色,管壁产生水珠;
(3)在固体中加入过量稀盐酸后四氧化三铁、铁和盐酸以及铁和氯化铁之间发生反应,其方程式为Fe3O4+8HCl=FeCl2+2FeCl3+4H2O、Fe+2HCl=FeCl2+H2↑、Fe+2FeCl3=3FeCl2;
(4)①因为氯气具有强氧化性,所以能将二价铁离子氧化为三价铁离子,因此步骤I中通入Cl2的作用是将Fe2+氧化成Fe3+;
②检验三价铁应该用KSCN溶液,观察是否变红,即检验滤液中Fe3+的操作方法是:取少量滤液,滴入几滴KSCN溶液,观察溶液是否变红色;
③由FeCl3稀溶液得到FeCl36H2O晶体需加热浓缩、冷却结晶、过滤。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3等杂质)中提取氧化铝的两种工艺流程如图:
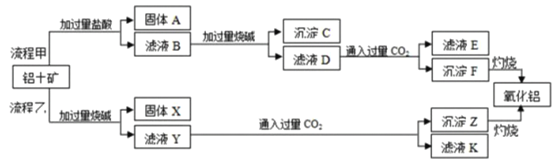
请回答下列问题:
(1)固体A的主要成分是___(写名称)。
(2)铝土矿与过量盐酸反应的离子方程式为___、___。
(3)电解熔融氧化铝可制得单质铝,写出该反应化学方程式____;已知氯化铝的熔点更低,工业中为何不用电解熔融氯化铝的方法制备该单质___。
(4)得到的单质铝可以跟强碱溶液放出氢气,每转移6.02×1025个电子,实际上参与反应的氧化剂为___mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:A(g)+B(g) ![]() C(s)+2D(g)的ΔH>0,下图所示为正逆反应速率(v)与时间(t)的关系,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤移走C,符合图示的条件是( )。
C(s)+2D(g)的ΔH>0,下图所示为正逆反应速率(v)与时间(t)的关系,如果在t1时刻改变以下条件:①加入A;②加入催化剂;③加压;④升温;⑤移走C,符合图示的条件是( )。
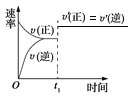
A. ②③B. ①②C. ③④D. ④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学利用如图所示装置探究二氧化硫气体的性质。
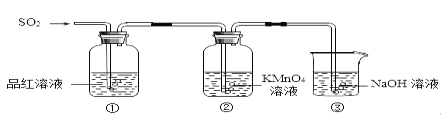
请回答:
(1)实验室用铜和浓硫酸共热制取二氧化硫,反应的化学方程式是_________。
(2)当观察到②中溶液颜色变浅时,①中的现象是_________。
(3)装置③的作用是________。
(4)①、②中的现象说明二氧化硫具有的性质是_________。
(5)③中涉及的化学反应方程式是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年度诺贝尔化学奖授予美国得州大学奥斯汀分校JohnB.Goodenough教授等人,以表彰其在锂离子电池的发展方面作出的突出贡献。研究表明:Li-Cu4O(PO4)2电池的正极的活性物质Cu4O(PO4)2制备的原理为:2Na3PO4+4CuSO4+2NH3·H2O=Cu4O(PO4)2↓+3Na2SO4+(NH4)2SO4+H2O。请回答:
(1)在周期表中,与Li的化学性质最相似的邻族元素在周期表中位置是__。
(2)Cu4O(PO4)2中Cu2+基态电子排布式为__,PO43-的空间构型是___。
(3)在硫酸铜溶液中加入过量KCN,生成配合物[Cu(CN)4]2-,则[Cu(CN)4]2-中含有的σ键与π键的数目比为__。
(4)(NH4)2SO4中电负性最大的元素是__。所含化学键的类型有__。
(5)冰晶胞中水分子的空间排列方式与金刚石晶胞类似,如图:
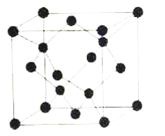
①每个冰晶胞平均占有__个水分子,冰的熔点远低于金刚石熔点的原因是__。
②在气相中NH3易与H2O通过氢键以水合物形式存在。试写出水合物NH3·H2O的结构式:__。
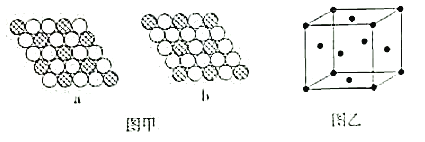
(6)如图甲所示为二维平面晶体示意图。其中表示CuCl2的晶体结构的是___(填“a”或“b”)。金属铜的晶胞如图乙所示,铜原子的配位数是__。若此晶胞立方体的边长为apm,金属铜的密度为ρg·cm-3,则阿伏加德罗常数可表示为___mol-1(用含a、ρ的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.我国自主研发的“龙芯1号”CPU芯片与光导纤维是同种材料
B.普通玻璃是以纯碱、石灰石和石英砂为原料制备的
C.水晶项链和餐桌上的瓷盘都是硅酸盐制品
D.粗硅制备单晶硅不涉及氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)请根据官能团的不同对下列有机物进行分类。
①CH3CH2OH ②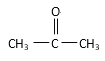 ③CH3CH2Br ④CH3COOCH2CH3 ⑤
③CH3CH2Br ④CH3COOCH2CH3 ⑤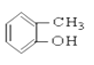 ⑥
⑥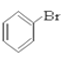 ⑦CH3CHO ⑧HCOOH ⑨
⑦CH3CHO ⑧HCOOH ⑨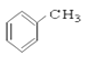 ⑩
⑩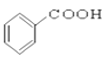
(1)芳香烃:____________
(2)卤代烃:______________
(3)醇:__________
(4)酚:______________
(5)醛:______________
(6)酮:_______________
(7)羧酸:___________________
(8)酯:______________________
(Ⅱ)![]() 的分子式为________________,
的分子式为________________,![]() 中含有的官能团的名称为________________ 。
中含有的官能团的名称为________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用如下装置制取氯化铁粉末,已知氯化铁粉末很容易吸水生成结晶化合物FeCl3+6H2O = FeCl3·6H2O
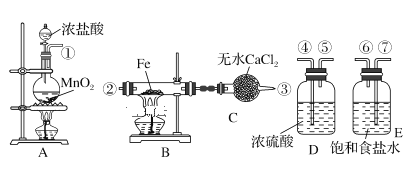
(1)按照气体流向从左到右顺序连接仪器应是(填仪器接口顺序,各接口序号间用“—”连接):①—_____。
(2)烧瓶A中反应的离子方程式为________,其中,氧化剂是________(填物质名称)。
(3)B中反应的化学方程式是_____________。
(4)装置C的作用是_______________。
(5)A、B中的酒精灯应先点燃____处(填“A”或“B”)的酒精灯,理由是__________。
(6)小明同学认为这套实验装置不完整,还须补充________装置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.按要求写出下列反应的方程式
(1)铝与足量氢氧化钠溶液反应的离子方程式 ______
(2)过氧化钠与水反应的化学方程式 ____
(3) 实验室制氢氧化铝的离子方程式 ________
Ⅱ. 请补充完整,配平方程式并用单线桥标出电子转移方向和数目
(1)KI+KIO3+H2SO4═I2+K2SO4+H2O:________________________
(2)MnO4-+NO2-+ ═Mn2++NO3-+H2O:_________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com