
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应N2(g)+3H2(g)![]() 2NH3(g),673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
2NH3(g),673 K、30 MPa下,n(NH3)和n(H2)随时间变化的关系如图所示。下列叙述正确的是
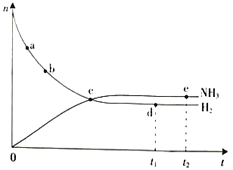
A.点c处反应达到平衡
B.点a的正反应速率比点b的大
C.点d(t1时刻)和点e(t2时刻)处n(N2)不一样
D.点d(t1时刻)和点e(t2时刻)处正逆速率不相等。
科目:高中化学 来源: 题型:
【题目】氯吡格雷是一种用于抑制血小板聚集的药物,该药物通常以 2-氯苯甲醛为原料合成,合成路线如下:
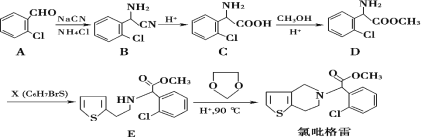
(1)下列关于氯吡格雷的说法正确的是__________。
A.氯吡格雷在一定条件下能发生消去反应
B.氯吡格雷难溶于水,在一定条件下能发生水解反应
C.1mol氯吡格雷含有5NA个碳碳双键,一定条件下最多能与5molH2发生加成反应
D.氯吡格雷的分子式为C16H16ClNO2S
(2)物质 D 的核磁共振氢谱有_________种吸收峰。
(3)物质 X 的结构简式为____________。
(4)物质 C可在一定条件下反应生成一种含有 3个六元环的产物,写出该反应的化学方程式______,反应类型是__________。
(5)写出属于芳香族化合物 A的同分异构体__________(不包含 A)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是( )
A.将淀粉水解并检验其产物,加液顺序为:淀粉溶液→稀硫酸→新制的![]() 悬浊液
悬浊液
B.![]() 能发生酯化、加聚、水解等反应
能发生酯化、加聚、水解等反应
C.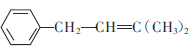 是重要有机化工产
是重要有机化工产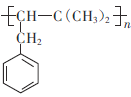 的单体
的单体
D.二环[1,1,0]丁烷(![]() )的分子式为
)的分子式为![]() ,其二氯代物有3种(不考虑立体异构)
,其二氯代物有3种(不考虑立体异构)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验验证非金属元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。他设计了如图所示装置以验证氮、碳、硅元素的非金属性强弱。
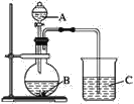
该同学设计的实验可直接证明三种酸的酸性强弱,已知A是强酸,常温下可与铜反应;B是块状固体;打开分液漏斗的活塞后,C中可观察到有白色沉淀生成。
(1)写出所选用物质的化学式:A.___B.____C.___
(2)写出烧杯中发生反应的离子方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的氯气通入250mL溴化钾溶液中,然后将所得的溶液蒸干,并将残渣灼烧,得到干燥的残渣40g,分析残渣,其中含25%的化合态的溴。
(1)通入氯气(无剩余)的质量是___。
(2)原溴化钾溶液含溴化钾的质量是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设N为阿伏加德罗常数的值。下列说法正确的是( )
A.密闭容器中![]() 和
和![]() 催化反应后原子总数小于
催化反应后原子总数小于![]()
B.![]() 的浓盐酸与足量
的浓盐酸与足量![]() 共热,电子转移的数目为
共热,电子转移的数目为![]()
C.向![]() 溶液中滴加氨水至溶液呈中性混合液中
溶液中滴加氨水至溶液呈中性混合液中![]() 的数目为
的数目为![]()
D.在标准状况下,![]() 二氯乙烷(
二氯乙烷(![]() )中含有极性键的数目为
)中含有极性键的数目为![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在![]() 存在下利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示。下列说法正确的是( )
存在下利用微生物电化学技术实现含苯酚废水的有效处理,其工作原理如图所示。下列说法正确的是( )
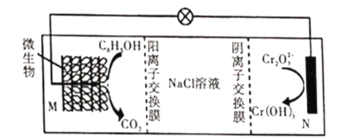
A.M极为电源负极,苯酚被氧化
B.工作一段时间后![]() 浓度增大
浓度增大
C.M极的电极反应为![]()
![]()
D.处理![]() 时,有
时,有![]() 从阴离子交换膜左侧向右侧移动
从阴离子交换膜左侧向右侧移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Pd/A12O3是常见的汽车尾气催化剂。一种从废Pd/A12O3纳米催化剂(主要成分及含量:Pd0.3%,γ-A12O392.8%,其他杂质6.0%)中回收金属Pd的工艺:
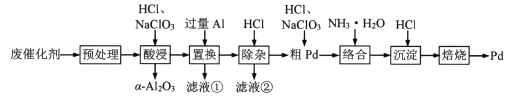
已知:γ-Al2O3能与酸反应,α-A12O3不与酸反应。
回答下列问题:
(1)“预处理”时,γ-A12O3经焙烧转化为α-A12O3,该操作的主要目的是_________。
(2)“酸浸”时,Pd转化为PdCl42-,其离子方程式为_________。
(3)“滤液①”和“滤液②”中都含有的主要溶质有_________(填化学式)。
(4)“粗Pd”溶解时,可用稀HNO3替代NaClO3,但缺点是_________。两者相比,_________(填化学式)的氧化效率更高(氧化效率以单位质量得到的电子数表示)。
(5)“沉淀”时,[Pd(NH3)4]2+转化为[Pd(NH3)2]Cl2沉淀,其化学方程式为_________。
(6)酸性条件下,BrO3-能在负载Pd/A12O3纳米催化剂的电极表面快速转化为Br-。
①发生上述转化反应的电极应接电源的_________极(填“正”或“负”);
②研究表明,电流密度越大,电催化效率越高;但当电流密度过大时,该电极会发生副反应生成_________填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )

①Cu为负极,Zn为正极
②Cu极上有气泡产生,发生还原反应
③SO42-向Cu极移动
④若有0.5mol电子流经导线,则可产生0.25mol气体
⑤电子的流向是:Cu→Zn
⑥正极反应式:Cu+2e-=Cu2+,发生氧化反应
A. ①②③B. ②④⑥
C. ②④D. ③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com