
| m |
| M |
| 14.2g |
| 142g/mol |
| n |
| V |
| 0.1mol |
| 0.5L |
| C1V1 |
| V2 |
| 0.2mol/L×0.05L |
| 0.1L |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解
(12分)补铁药物“速力菲”说明书部分内容摘录:
【规格】每片含琥珀酸亚铁0.1g
【组成与性状】内含Fe2+34.0%~36.0%的无水碱式盐,为薄膜糖衣片
【适应症】用于缺铁性贫血症预防及治疗
【用量用法】成人预防量0.1g/日,治疗量0.2g~0.4g/日;小儿预防量30~60mg/日,治疗量0.1g~0.3g/日
【储藏】在避光、密封、阴凉处保存
【药物相互作用】与维生素C同服,可增加本品吸收;该药片在水和乙醇中溶解度不大。
现某学校化学实验小组,为了检测“速力菲”药片中亚铁元素的存在,设计了如下几组实验:
Ⅰ、理论设计方案: 甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果,
(1)甲组实验失败的可能原因:________________________________________________。
乙组同学认真思考了甲组实验失败的原因,模拟药片服用后在人体中溶解的变化过程,重新设计并完成下列实验:
(2)若试剂1为盐酸;则试剂2为________________________________。
丙组同学对乙组实验中最后红色褪去的现象产生了研究兴趣,探讨褪色的原因,根据微粒的组成,他们认为有两种可能的原因:
[Fe(SCN)]2+络离子中的三价铁被还原为亚铁
② 。
(3)请你对其中一种可能进行实验验证:________________________________
实验方案(用文字述):________________________________________________,
根据预期现象判断结论:________________________________________________________。
Ⅱ、(4)称量“速力菲”1.0 g,将其全部溶于稀硫酸中,配制成100.00 mL溶液,取出20.00 mL,用0.01000 mol/L的KMnO4溶液滴定。三次操作读数如下:
| 序号 | V(KMnO4)初 | V(KMnO4)终 | V(KMnO4) |
| 1 | 2.24mL | 14.25mL | 12.01mL |
| 2 | 0.30mL | 12.72mL | 12.42mL |
| 3 | 0.50mL | 12.53 | 12.03mL |
计算:该补血药中含Fe2+的质量分数________________(保留小数点后二位小数)。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽合肥八中高三第四次月考化学试卷 题型:实验题
(12分)补铁药物“速力菲”说明书部分内容摘录:
【规格】每片含琥珀酸亚铁0.1g
【组成与性状】内含Fe2+34.0%~36.0%的无水碱式盐,为薄膜糖衣片
【适应症】用于缺铁性贫血症预防及治疗
【用量用法】成人预防量0.1g/日,治疗量0.2g~0.4g/日;小儿预防量30~60mg/日,治疗量0.1g~0.3g/日
【储藏】在避光、密封、阴凉处保存
【药物相互作用】与维生素C同服,可增加本品吸收;该药片在水和乙醇中溶解度不大。
现某学校化学实验小组,为了检测“速力菲”药片中亚铁元素的存在,设计了如下几组实验:
Ⅰ、理论设计方案:
 甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果,
甲组同学按照设计的方案完成实验,但遗憾的是他们没有得到预期的实验结果,
(1)甲组实验失败的可能原因:________________________________________________ 。
乙组同学认真思考了甲组实验失败的原因,模拟药片服用后在人体中溶解的变化过程,重新设计并完成下列实验:

(2)若试剂1为盐酸;则试剂2为________________________________。
丙组同学对乙组实验中最后红色褪去的现象产生了研究兴趣,探讨褪色的原因,根据微粒的组成,他们认为有两种可能的原因:
[Fe(SCN)]2+络离子中的三价铁被还原为亚铁
② 。
(3)请你对其中一种可能进行实验验证:________________________________
实验方案(用文字述):________________________________________________ ,
根据预期现象判断结论:________________________________________________________ 。
Ⅱ、(4)称量“速力菲”1.0 g,将其全部溶于稀硫酸中,配制成100.00 mL溶液,取出20.00 mL,用0.01000 mol/L的KMnO4溶液滴定。三次操作读数如下:
|
序号 |
V(KMnO4)初 |
V(KMnO4)终 |
V(KMnO4) |
|
1 |
2.24mL |
14.25mL |
12.01mL |
|
2 |
0.30mL |
12.72mL |
12.42mL |
|
3 |
0.50mL |
12.53 |
12.03mL |
计算:该补血药中含Fe2+的质量分数________________(保留小数点后二位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ.某校化学课外小组用硫酸铁废液(含少量硫酸铜和稀硫酸),制备硫酸亚铁晶体并进行如下实验。制备硫酸亚铁晶体主要的操作流程如下:
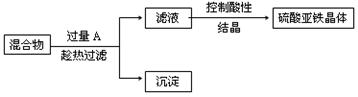
请根据题目要求回答下列问题:
(1)趁热过滤的目的是 。
(2)加入过量A,溶液中发生的离子方程式有 。
(3)结晶操作过程中应控制滤液酸性的原因是 ,结晶析出晶体后,用过滤的方法从溶液得到晶体,洗涤晶体的实验操作是 。
(4)实验室利用硫酸亚铁溶液和草酸溶液反应生成草酸亚铁沉淀来制备草酸亚铁。写出该反应的离子方程式 。
Ⅱ.草酸亚铁晶体(FeC2O4·2H2O,相对分子质量180)受热易分解,某课外小组设计如图的实验装置来检验其分解产物。
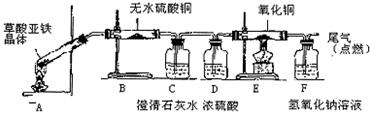
(5)该装置中最不合理的部分__________(填字母),原因是__________________________。
(6)写出B、C处的现象___________________________________________。
(7)当72.0g FeC2O4·2H2O完全反应后,残留混合物质量为27.2g,无水硫酸铜增重14.4g,C装置增重22.0g。求残留混合物的成分和物质的量 。(假设每个实验装置的药品足量,气体被充分吸收)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com