
| 元素符号 | 元素性质或原子结构 |
| A | A是形成化合物最多的元素 |
| B | B元素的单质在空气中含量最多 |
| C | C元素在地壳中含量最多 |
| D | D元素在同周期中金属性最强 |
| E | 常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积 |
分析 A、B、C、D、E均为短周期元素,且原子序数依次增大,A是形成化合物最多的元素,则A为碳元素;B元素的单质在空气中含量最多,则B为N元素;C元素在地壳中含量最多,则C为O元素;D元素在同周期中金属性最强,原子序数大于氧,处于第三周期IA族,故D为Na;常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积,则E为S元素,据此解答.
解答 解:A、B、C、D、E均为短周期元素,且原子序数依次增大,A是形成化合物最多的元素,则A为碳元素;B元素的单质在空气中含量最多,则B为N元素;C元素在地壳中含量最多,则C为O元素;D元素在同周期中金属性最强,原子序数大于氧,处于第三周期IA族,故D为Na;常温常压下,E元素形成的单质是淡黄色固体,常在火山口附近沉积,则E为S元素.
(1)E为硫元素,在元素周期表中的位置:第三周期第ⅥA族,
故答案为:第三周期第ⅥA族;
(2)B的最简单气态氢化物为NH3,分子空间构型为三角锥形,由于NH3分子间能形成氢键,其沸点高于同主族的其它气态氢化物,
故答案为:三角锥形;NH3分子间能形成氢键;
(3)D的最高价氧化物对应水化物为NaOH,含有离子键、共价键,
故答案为:离子键、共价键;
(4)电子层结构相同,核电荷数越大离子半径越小,电子层越多离子半径越大,故离子半径:S2->N3->O2->Na+,
故答案为:S2->N3->O2->Na+;
(5)由C、N、O与H元素组成的一种常见的酸式盐为NH4HCO3,D的最高价氧化物对应的水化物为NaOH,碳酸氢铵与过量的NaOH反应的离子方程式为:NH4++HCO3-+2OH-=NH3.H2O+CO32-+H2O;
在25℃,101kPa下,2g硫单质在O2气体中完全燃烧后恢复到原状态,放热18.72kJ,则1molS反应方程式的热量为18.72kJ×$\frac{1mol×32g/mol}{2g}$=299.52kJ,该反应的热化学方程式为:S(s)+O2(g)=SO2(g)△H=-299.52kJ/mol,
故答案为:NH4++HCO3-+2OH-=NH3.H2O+CO32-+H2O;S(s)+O2(g)=SO2(g)△H=-299.52kJ/mol.
点评 本题考查位置结构性质关系综合应用,涉及分子构型、氢键、微粒半径比较、离子方程式、热化学方程式等,推断元素是解题关键,是对学生综合能力的考查,注意对基础知识的理解掌握.


科目:高中化学 来源: 题型:解答题
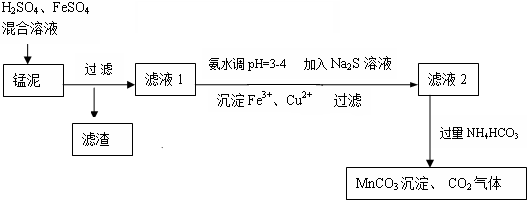
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8n | B. | 18n | C. | 14n | D. | 44n |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
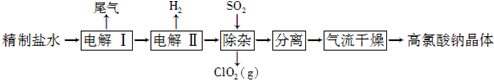
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
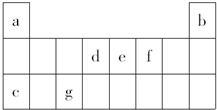 如表是元素周期表中的一部分,表中所列字母分别表示一种元素.(选项中的物质都由下表中的元素组成)由表中信息可推断下列说法正确的是( )
如表是元素周期表中的一部分,表中所列字母分别表示一种元素.(选项中的物质都由下表中的元素组成)由表中信息可推断下列说法正确的是( )| A. | 宇航员在飞船活动舱内会产生d和f组成的气体,吸收这种气体的化合物应该由e和f组成 | |
| B. | 活动舱内还要营造一种适合宇航员生存的人工生态环境,即充入a和f的常见单质 | |
| C. | c和f以原子个数之比为1:1组成的化合物可用作宇航员所需f单质的来源 | |
| D. | 《阿凡达》中潘多拉星球上存在32b,地球上此元素主要以42b形式存在,32b比42b少一个质子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
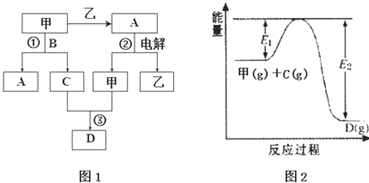
| 容器编号 | n(甲) | n(C) | n(D) | v正与v逆的关系 |
| Ⅰ | 0.20 | 0.10 | 0.20 | v正=v逆 |
| Ⅱ | 0.20 | 0.40 | 1.00 | ②? |
| Ⅲ | 0.60 | 1.20 | 0.80 | ③? |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 与金属钠反应时,只有键①断裂 | B. | 在Ag催化下与O2反应时,键①、③断裂 | ||
| C. | 与CuO反应时,只有键①断裂 | D. | 与浓硫酸共热至170℃时,键②、⑤断裂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | OCS中含有1个σ键和1个π键 | |
| B. | OCS高温分解时,碳元素化合价升高 | |
| C. | OCS、C02、CO、S晶体类型相同 | |
| D. | 22.4LOCS中约含有3×6.02×1023个原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾常作净水剂 | |
| B. | 与铜质水龙头连接处的钢质水管易发生腐蚀 | |
| C. | 在水果贮藏室中,放几块被KMnO4溶液浸透过的“砖块”,可延长水果保存时间 | |
| D. | 汽车尾气中的CO、NO等都是汽油和柴油的不完全燃烧产物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com