
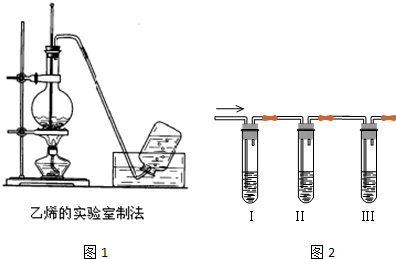
分析 (1)①混合液体先加密度小的,再加密度大的液体;
②碎瓷片可防止液体剧烈沸腾;
③乙醇发生消去反应生成乙烯,若控制温度为140℃发生副反应生成乙醚;
(2)反应中生成的乙烯中会含有CO2和SO2杂质气体,检验乙烯的化学性质由图可知,I中为NaOH可吸收二氧化硫、二氧化碳,II中品红检验二氧化硫除尽,Ⅲ中盛有溴的四氯化碳溶液褪色,可知乙烯与溴发生加成反应.
解答 解:(1)①配制20ml体积比约为1:3的乙醇和浓硫酸的混合液的方法是在烧杯中加入5mL 95%的乙醇,然后滴加15mL浓硫酸,边加边振荡,
故答案为:在烧杯中加入5mL 95%的乙醇,然后滴加15mL浓硫酸,边加边振荡;
②加几片碎瓷片的目的是避免混合液在受热时暴沸,
故答案为:避免混合液在受热时暴沸;
③反应的化学方程式为CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O,为消去反应;若实验中温度控制在140℃左右,则产物是乙醚,此时的反应类型属于取代反应,
故答案为:CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2↑+H2O;消去反应;乙醚;取代反应;
(2)①装置I中盛有NaOH溶液,目的是除去CO2和SO2杂质气体,反应的离子方程式为CO2+2OH?=CO32-+H2O、SO2+2OH?=SO32?+H2O,
故答案为:除去CO2和SO2杂质气体;CO2+2OH?=CO32-+H2O、SO2+2OH?=SO32?+H2O;
②装置II中盛有品红溶液,目的是检验SO2是否除尽,
故答案为:检验SO2是否除尽;
③装置Ⅲ中盛有溴的四氯化碳溶液,可观察到的现象是溶液褪色;反应的化学方程式是CH2=CH2+Br2→CH2BrCH2Br,
故答案为:溶液褪色;CH2=CH2+Br2→CH2BrCH2Br.
点评 本题考查有机物的制备实验及性质实验,为高频考点,把握反应原理、实验装置的作用、实验技能等为解答的关键,侧重分析与实验能力的考查,注意有机物性质的应用,综合性较强,题目难度中等.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大压强 | B. | 升高温度 | C. | 增大CH4浓度 | D. | 更换高效催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| t/s | 0 | 500 | 1000 |
| c(N2O5) mol/L | 5.00 | 3.25 | 2.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
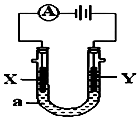 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com