
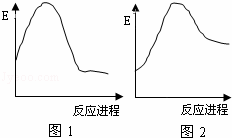
图中E表示反应物或生成物的能量,下列说法正确的是( )
|
| A. | 图1可表示C+O2→CO2的能量变化过程 |
|
| B. | 图1可表示CaCO3→CaO+CO2的能量变化过程 |
|
| C. | 图2可表示Mg+2HCl→MgCl2+H2 的能量变化过程 |
|
| D. | 图1表示的反应是吸热反应,图2表示的反应是放热反应 |
| 反应热和焓变. | |
| 专题: | 化学反应中的能量变化. |
| 分析: | 从图1可见,其表示的反应,反应物的能量比生成物的能量高,是表示放热反应的;从图2可见,其表示的反应,反应物的能量比生成物的能量低,是表示吸热反应的. |
| 解答: | 解:A、从图1可见,其表示的反应,反应物的能量比生成物的能量高,是表示放热反应的,而C+O2→CO2为放热反应,故A正确; B、从图1可见,其表示的反应,反应物的能量比生成物的能量高,是表示放热反应的,而CaCO3→CaO+CO2为吸热反应,故B错误; C、从图2可见,其表示的反应,反应物的能量比生成物的能量低,是表示吸热反应,而Mg+2HCl→MgCl2+H2 为放热反应,故C错误; D、从图1可见,其表示的反应,反应物的能量比生成物的能量高,是表示放热反应的;从图2可见,其表示的反应,反应物的能量比生成物的能量低,是表示吸热反应,故D错误. 故选:A. |
| 点评: | 本题主要是认识放热、吸热反应的图示方法,并了解反应放热和吸热的原因以及与反应条件的关系. |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
下列推断正确的是( )
A.N2、NO、NO2都是大气污染气体,在空气中都能稳定存在
B.向AlCl3溶液中滴加过量的氨水能看到先产生白色沉淀,后沉淀溶解
C.可用浓硫酸或者浓硝酸除去镀在铝表面的铜镀层
D.在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉就会溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素的同位素AZX,它的氯化物XCl2 1.11g溶于水制成溶液后, 加入1mol/L的AgNO3溶液20ml恰好完全反应.若这种同位素原子核内有20个中子,求:
(1)Z值_________和A值___________
(2)X元素在周期表中的位置__________________________________;
(3)写出X单质与水反应的化学方程式._____________________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
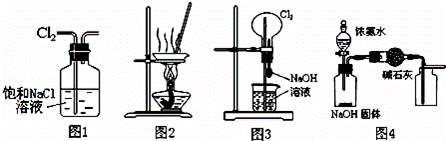
下列有关实验装置进行的相应实验,不能达到实验目的是( )
|
| A. | 用图1所示装置除去Cl2中含有的少量HCl |
|
| B. | 用图2所示装置蒸发KCl溶液制备无水KCl |
|
| C. | 用图3所示装置可以完成“喷泉”实验 |
|
| D. | 用图4所示装置制取、收集干燥纯净的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
乙醇是一种非常重要的烃的衍生物,是无色有特殊气味的液体.某校化学兴趣小组对乙醇的结构和性质进行了以下探究,请你参与并完成对有关问题的解答.
【观察与思考】
(1)乙醇分子的核磁共振氢谱有 个吸收峰.
【活动与探究】
(2)甲同学向小烧杯中加入无水乙醇,再放入一小块金属钠(约绿豆粒大),观察实验现象.请在下表中将观察到的实验现象及结论补充完全(有多少现象就填多少,不必填满).
| 实验现象 | 结论 | |
| ① | 钠沉在乙醇下面 | 钠的密度大于乙醇 |
| ② | ||
(3)乙同学向试管中加入3~4mL无水乙醇,浸入50℃左右的热水中,再将铜丝烧至红热,迅速插入乙醇中,反复多次.则此时乙醇发生反应的化学方程式为(生成乙醛) .欲验证此实验的有机产物,可以将产物加入盛有 的试管中并在水浴中加热,观察现象即可,此反应的化学方程式为 .
【交流与讨论】
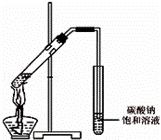
(4)丙同学向一支试管中加入3mL乙醇,然后边摇动试管边慢慢加入2mL浓硫酸和2mL冰醋酸,按图所示连接好装置,开始实验.请回答下列问题:
①请指出该装置的主要错误是 .
②浓硫酸的作用是 、 .
③假如乙醇分子中的氧原子为18O,请写出此反应的化学方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
燃料电池的设计原理是基于将燃料燃烧时的化学能转变为电能,所以凡是燃料的燃烧反应从原理上说都可以设计成原电池反应,下列说法正确的是( )
|
| A. | 燃料电池工作时O2在正极上发生氧化反应 |
|
| B. | 燃料电池工作时O2在负极上发生氧化反应 |
|
| C. | 燃料电池工作时燃料在负极上发生还原反应 |
|
| D. | 燃料电池若以KOH溶液为介质,则工作时不会产生CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法不正确的( )
|
| A. | 化学反应速率大小的决定因素是反应物的性质 |
|
| B. | 所有化学反应,温度升高其反应速率一定增大 |
|
| C. | 钢铁腐蚀、熟料老化、食物腐败等都是化学变化,减小这些反应的速率有利于生产、生活及可持续发展 |
|
| D. | 硫酸工业、硝酸工业、铁的冶炼等都涉及到化学反应且都会产生污染,减小这些反应的速率有利于降低对环境的污染也有利于国民经济的可持续发展 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下表是在相同温度下三种酸的一些数据,下列判断正确的是
| 酸 | HX | HY | HZ | ||
| 浓度(mol/L) | 0.12 | 0.2 | 0.9 | 1 | 1 |
| 电离度 | 0.25 | 0.2 | 0.1 | 0.3 | 0.5 |
| 电离常数 | K1 | K2 | K3 | K4 | K5 |
A.在相同温度,从HX的数据可以说明:弱电解质溶液,浓度越低,电离度越大,且K1>K2>K3=0.01
B.室温时,若在NaZ溶液中加水,则c((Z-)/ [c(HZ)• c(OH-)]的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ的混合液,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.在相同温度下,K5>K4>K3
查看答案和解析>>
科目:高中化学 来源: 题型:
1mol•L﹣1硫酸溶液的含义是( )
|
| A. | 1L水中含有1mol硫酸 |
|
| B. | 1L溶液中含1mol H+ |
|
| C. | 将98g硫酸溶于1L水所配成的溶液 |
|
| D. | 指1L硫酸溶液中含有98g H2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com