
| A. | 通过树状分类法可把硝酸和硫酸分入强酸,把纯碱分入正盐 | |
| B. | 若按交叉分类法分类,碳酸钠既属于钠盐,又属于碳酸盐 | |
| C. | 先加入稀盐酸,没有产生沉淀,然后再加氯化钡,产生白色沉淀,证明有SO42-存在 | |
| D. | 先加入氯化钡,产生白色沉淀,然后再加稀盐酸,沉淀不溶解,证明有SO42-存在 |
分析 A、树状分类法是一种很形象的分类法,按照层次,一层一层来分,就像一棵大树,有叶、枝、杆、根,各层之间是包含和被包含的关系;
B、交叉分类法是对同一化学物质或化学反应采用不同的“标准”进行分类;
C、SO32-、CO32-也能和Ba2+生成白色沉淀,故在检验SO42-的过程中要注意排除SO32-、CO32- 等离子的影响,据此分析;
D、SO32-、CO32-也能和Ba2+生成白色沉淀,故在检验SO42-的过程中要注意排除SO32-、CO32- 等离子的影响,据此分析.
解答 解:A、硝酸和硫酸都属于强酸,纯碱为碳酸钠,所以通过树状分类法可把硝酸和硫酸分入强酸,把纯碱分入正盐,故A正确;
B、Na2CO3从组成的阳离子来看,其属于钠盐,而从组成的阴离子来看,其又属于碳酸盐,可以看到,从不同的角度分类,Na2CO3属于不同的类别,出现了交叉现象,因此分类方法属于交叉分类法,故B正确;
C、先加稀盐酸,会将SO32-、CO32-均反应掉,再加BaCl2,如果还生成白色沉淀,则说明溶液中含SO42-,故C正确;
D、先加BaCl2,如果生成白色沉淀,则白色沉淀可能是BaCO3或BaSO3或BaSO4,还可能是AgCl,再加稀盐酸,BaCO3或BaSO3均溶解,但BaSO4和AgCl均不溶解,故原溶液中可能含SO42-,也可能含Ag+,故D错误.
故选D.
点评 本题考查了物质的分类方法、氧化还原反应的判断、阿伏伽德罗常数的意义等知识,注意知识的归纳和梳理是关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
 酚;
酚;  芳香烃;
芳香烃; 酯;
酯;  烯烃.
烯烃.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

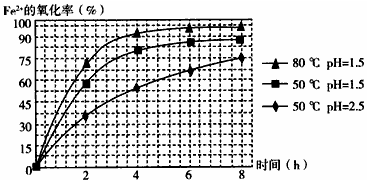
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向Na2SiO3溶液中滴加1滴酚酞,然后逐滴加入稀盐酸至红色退去 | 2min后,出现凝胶 | 酸性:HCl>H2SiO3 |
| B | 在SiO2中加入蒸馏水,振荡 | SiO2溶解 | SiO2是H2SiO3的酸酐 |
| C | 常温下,向浓硫酸中投入铁片 | 铁片不溶解 | 常温下,铁与浓硫酸不反应 |
| D | 向某溶液中先滴加少量氯水,一会儿后滴加KSCN溶液 | 滴加氯水时无明显现象,滴加KSCN溶液后,混合液变成红色 | 原溶液中含有Fe2+,没有Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Fe3+、I-、Cl-三种离子一定存在 | |
| B. | CO32-一定不存在,不能确定Na+和Cl-是否存在 | |
| C. | Fe3+与Fe2+至少有一种 | |
| D. | 该溶液中c(Cl-)至少为0.2mol•L?1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成 | 该溶液中一定含有SO42- |
| B | 向某溶液中滴加NaOH溶液,产生白色沉淀 | 该溶液中一定含有Al3+ |
| C | 向某溶液中加人NaOH浓溶液,加热,产生的气体能使湿润的 红色石蕊试纸变蓝 | 该溶液中一定含有NH4+ |
| D | 向某紫红色溶液中加人过量Na2SO3溶液,溶液紫红色褪去 | 该溶液中一定含有MnO4- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  实验:振荡后静置,上层溶液颜色保持不变 | |
| B. |  实验:试管溶液中出现气泡,溶液先出现浑浊后变澄清 | |
| C. |  实验:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色 | |
| D. | 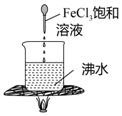 实验:加热至混合液呈红褐色,停止加热,该分散系能产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 ;A 分子中能够共平面的原子 最多为8个,写出A与溴的四氯化碳反应的化学方程式
;A 分子中能够共平面的原子 最多为8个,写出A与溴的四氯化碳反应的化学方程式 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com