
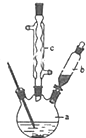
 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱之一.下面是它的一种实验室合成路线: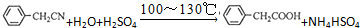

分析 (1)配制此硫酸时,应将密度大的注入密度小的液体中,防止混合时放出热使液滴飞溅;
(2)由图可知,c为冷凝管,使气化的液体冷凝回流,仪器b可加入反应液;
(3)反应结束后加适量冷水,降低温度,减小苯乙酸的溶解度;分离苯乙酸粗品,利用过滤操作;
(4)苯乙酸微溶于冷水,在水中的溶解度较小,提纯苯乙酸的方法是重结晶,;由反应 可知,40g苯乙腈生成苯乙酸为40g×$\frac{136}{117}$=46.5g;
可知,40g苯乙腈生成苯乙酸为40g×$\frac{136}{117}$=46.5g;
(5)苯乙酸微溶于冷水,溶于乙醇,混合溶剂中乙醇可增大苯乙酸的溶解度.
解答 解:(1)稀释浓硫酸放出大量的热,配制此硫酸时,应将密度大的注入密度小的液体中,防止混合时放出热使液滴飞溅,则加入蒸馏水与浓硫酸的先后顺序是先加水、再加入浓硫酸,
故答案为:先加水、再加入浓硫酸;
(2)由图可知,c为球形冷凝管,其作用为冷凝回流;
故答案为:球形冷凝管;冷凝回流;
(3)反应结束后加适量冷水,降低温度,减小苯乙酸的溶解度,则加入冷水可便于苯乙酸析出;分离苯乙酸粗品,利用过滤操作,则需要的仪器为漏斗、烧杯、玻璃棒,
故答案为:便于苯乙酸析出;BCE;
(4)苯乙酸微溶于冷水,在水中的溶解度较小,则提纯苯乙酸的方法是重结晶;由反应 可知,40g苯乙腈生成苯乙酸为40g×$\frac{136}{117}$=46.5g,最终得到44g纯品,则苯乙酸的产率是:$\frac{44g}{46.5g}$×100%=94.6%,
可知,40g苯乙腈生成苯乙酸为40g×$\frac{136}{117}$=46.5g,最终得到44g纯品,则苯乙酸的产率是:$\frac{44g}{46.5g}$×100%=94.6%,
故答案为:重结晶;94.6%;
(5)苯乙酸微溶于冷水,溶于乙醇,混合溶剂中乙醇可增大苯乙酸的溶解度,然后与Cu(OH)2反应除去苯乙酸,即混合溶剂中乙醇的作用是增大苯乙酸溶解度,便于充分反应,
故答案为:增大苯乙酸溶解度,便于充分反应.
点评 本题侧重物质制备实验及有机物性质的考查,把握合成反应及实验装置的作用为解答的关键,综合考查学生实验技能和分析解答问题的能力,题目难度中等,注意信息的处理及应用.


科目:高中化学 来源: 题型:选择题
| A. | 难溶电解质在水中存在沉淀溶解平衡,且是一种动态平衡 | |
| B. | Ksp只与难溶电解质的性质和温度有关,而与沉淀的量和离子浓度无关 | |
| C. | 在一定温度下的BaSO4饱和溶液中加入少量BaCl2固体,BaSO4的Ksp减少 | |
| D. | 当阴、阳离子个数比相同时,难溶电解质的Ksp数值越大,溶解能力越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
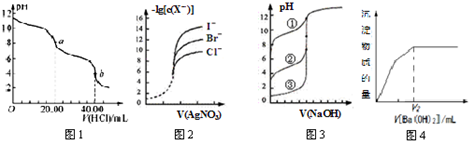
| A. | 图1是用0.l000 mol•L-1的盐酸滴定20.00 mL 0.l000mol•L-1Na2CO3溶液的曲线,从a→b点反应的离子方程式为:HCO3-+H+=CO2↑+H2O | |
| B. | 用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol/L Cl-、Br-及I-的混合溶液,由图2曲线,可确定首先沉淀的是Cl- | |
| C. | 用0.1000 mol/LNaOH溶液分别滴定浓度相同的三种一元酸,由图3曲线确定①的酸性最强 | |
| D. | 图Ⅳ表示明矾中滴入Ba(OH)2溶液,图中的V2表示生成的氢氧化铝恰好溶解时加入Ba(OH)2溶液的体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
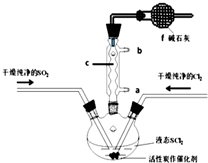 SOCl2是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:
SOCl2是一种液态化合物,沸点为77℃,在农药、制药行业中用途广泛.SOCl2遇水剧烈反应,液面上产生白雾,并带有刺激性气味的气体产生.实验室合成原理:SO2+Cl2+SCl2=2SOCl2,部分装置如图所示,回答以下问题:| 方案 | 甲 | 乙 | 丙 | 丁 |
| 发生装置 | 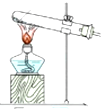 |  | 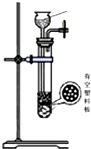 | 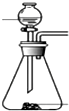 |
| 所选试剂 | NaHSO3固体 | 18.4mol/LH2SO4+Cu | 4mol/LHNO3+Na2SO | 70%H2SO4+K2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
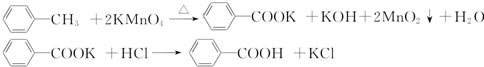
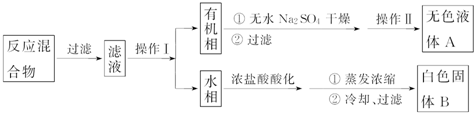
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶解,冷却结晶,过滤 | 得到白色晶体和无色滤液 | |
| ② | 取少量滤液于试管中,滴入稀HNO3酸化的AgNO3溶液 | 生成白色沉淀 | 滤液含Cl- |
| ③ | 干燥白色晶体,取适量加热,测定熔点 | 白色晶体在122.4℃熔化为液体 | 白色晶体是苯甲酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
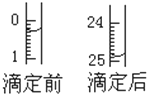 某学生用0.1mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
某学生用0.1mol•L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:| 滴定序号 | 待测液体积(mL) | 所消耗KOH标准液的体积(mL) | ||
| 滴定前 | 滴定后 | 消耗的体积 | ||
| 1 | 20.00 | 0.50 | 25.12 | 24.62 |
| 2 | 20.00 | 0.30 | 24.90 | 24.60 |
| 3 | 20.00 | 6.00 | 30.58 | 24.58 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
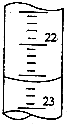 用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:
用中和滴定法测定烧碱的纯度,若烧碱中不含有与酸反应的杂质,试根据实验回答:| 滴定次数 | 待测液体积/mL | 标准盐酸体积/mL | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
| 第三次 | 10.00 | 4.20 | 25.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两烧杯中参加反应的锌粒等量 | |
| B. | 反应开始时产生H2的速率相等 | |
| C. | 反应开始后乙烧杯中的c(H+)始终比甲烧杯中的c(H+)大 | |
| D. | 甲烧杯中放入锌的质量一定比乙烧杯中放入锌的质量大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com