
| 选项 | 实验目的 | 实验过程 |
| A | 证明构成原电池能加快制取氢气速率 | 在锌与稀硫酸反应时加足量氧化铜 |
| B | 证明负极发生氧化反应,正极发生还原反应 | 将锌片、铜片分别放入硫酸铜溶液中 |
| C | 证明电极类型与电解质溶液有关 | 以铝、镁为电极,分别在氢氧化钠溶液、稀硫酸中构成原电池 |
| D | 证明Ag+的氧化性比Cu2+强 | 以石墨为电极,电解0.001mol•L-1AgNO3溶液和1mol•L-Cu(NO3)2溶液 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.加足量氧化铜消耗酸;
B.Zn、Cu与硫酸铜构成原电池,Zn为负极,Cu为正极;
C.NaOH为电解质,Al为负极;硫酸为电解质,Mg为负极;
D.以石墨为电极,阴极先析出Ag.
解答 解:A.加足量氧化铜消耗酸,生成氢气的速率减弱,不能说明原电池加快生成氢气的速率,故A错误;
B.Zn、Cu与硫酸铜构成原电池,Zn为负极,Cu为正极,则负极Zn失去电子发生氧化反应,而正极发生还原反应,故B正确;
C.NaOH为电解质,Al为负极;硫酸为电解质,Mg为负极,则电解质不同,电极不同,故C正确;
D.以石墨为电极,阴极先析出Ag,则Ag+的氧化性比Cu2+强,故D正确;
故选A.
点评 本题考查化学实验方案的设计,为高频考点,涉及反应速率、原电池及氧化性比较等,把握相关反应原理为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
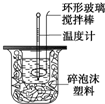 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:| 温度 实验次数 | 起始温 度t1℃ | 终止温度t2/℃ | 温度差平均值(t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
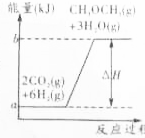 ,工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0MPa)和催化剂作用进行的,反应器中发生了下列反应:
,工业上制二甲醚是在一定温度(230~280℃)、压强(2.0~10.0MPa)和催化剂作用进行的,反应器中发生了下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8 | B. | 10 | C. | 12 | D. | 14 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4 mol | B. | 3.4 mol | C. | 2.8 mol | D. | 1.2 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能Y小于X | |
| B. | 最高价含氧酸的酸性:X对应的酸的酸性强于Y | |
| C. | 气态氢化物的稳定性:HmY强于HnX | |
| D. | X和Y形成化合物时,X显负价,Y显正价 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com