
| 选项 | 操作和现象 | 结论 |
| A. | 滴有酚酞的Na2CO3溶液中加入BaCl2溶液,红色变浅 | Na2CO3溶液中存在水解平衡 |
| B. | 向电石中加入饱和食盐水制乙炔,并将产生的气体直接填入酸性高锰酸钾溶液中,溶液紫红色褪去 | 记明乙炔能被酸性高锰酸钾氧化 |
| C. | 常温下,测得饱和Na2S溶液的PH大于饱和Na2CO3溶液 | 常温下水解程度:S2->CO32- |
| D. | 向分液漏斗中加入碘水后再加入CCl4,充分振荡,分层,且上层溶液至紫色 | CC14可作为碘的萃取剂 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.Na2CO3溶液水解显碱性,加氯化钡使水解平衡逆向移动;
B.乙炔中混有硫化氢气体,硫化氢也能够使酸性高锰酸钾溶液褪色;
C.没有说明两溶液浓度大小,无法比较水解程度;
D.四氯化碳的密度大于水,应该是下层呈紫色.
解答 解:A.Na2CO3溶液水解显碱性,加氯化钡使水解平衡逆向移动,则由溶液颜色的变化可知Na2CO3溶液中存在水解平衡,能够达到实验目的,故A正确;
B.生成的乙炔气体中含有硫化氢,硫化氢具有还原性,能够使酸性高锰酸钾溶液褪色,干扰了检验结果,故B错误;
C.饱和Na2S溶液与饱和Na2CO3溶液的浓度不相等,无法比较S2-、CO32-的水解程度,故C错误;
D.向分液漏斗中加入碘水后再加入CCl4,充分振荡,由于四氯化碳的密度大于水,则分层后下层溶液至紫色,故D错误;
故选A.
点评 本题考查化学实验方案的评价,题目难度中等,涉及盐的水解及其影响、物质分离与提纯、气体制备与检验等知识,明确盐的水解原理为解答关键,C为易错点,注意两溶液浓度不相等,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
 ”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )
”,tián),Ts的原子核外最外层电子数是7,下列说法不正确的是( )| A. | Ts是第七周期第ⅦA族元素 | |
| B. | Ts的同位素原子具有相同的电子数 | |
| C. | Ts在同族元素中非金属性最弱 | |
| D. | 中子数为176的Ts核素符号是${\;}_{117}^{176}$Ts |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:C<O<N | B. | 电负性:C>N>O | ||
| C. | 热稳定性:HF>H2O>H2S | D. | 酸性:HCl<HBr<HI |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
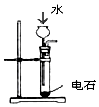 |  | 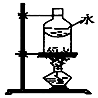 |  |
| 制乙炔的发生装置 | 蒸馏时的接收装置 | 分离固体氯化钠和碘单质 | 准确量取一定体积K2Cr2O7标准溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 活性炭具有还原性,可用作冰箱除味剂 | |
| B. | 二氧化硫具有氧化性,可用作造纸漂白剂 | |
| C. | Al2O3具有很高的熔点,可用于制造熔融烧碱的坩埚 | |
| D. | FeCl3溶液能与Cu反应,可用于蚀刻印刷电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
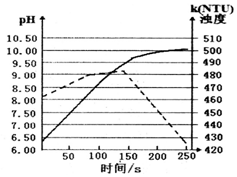 将打磨后的镁条放入盛有50mL蒸馏水的烧杯中,用pH传感器和浊度传感器监测溶液中pH和溶液浊度随时间的变化如图.下列有关描述正确的( )
将打磨后的镁条放入盛有50mL蒸馏水的烧杯中,用pH传感器和浊度传感器监测溶液中pH和溶液浊度随时间的变化如图.下列有关描述正确的( )| A. | 该实验是在常温下进行的 | |
| B. | 实线表示溶液浊度随时间的变化 | |
| C. | 50s时向溶液中滴入酚酞试液,溶液变红 | |
| D. | 150s后溶液浊度下降是因为生成的Mg(OH)2沉降 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
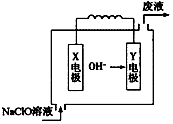 镁是一种重要的金属资源,在各领域都具有重要的作用.
镁是一种重要的金属资源,在各领域都具有重要的作用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com