
【题目】在含有1mol HNO3和2molH2SO4的混合稀溶液中,加入1.5molCu,加热充分反应,产生的气体在标准状况下的体积约为( )
A.5.6L
B.11.2L
C.22.4L
D.44.8L
科目:高中化学 来源: 题型:
【题目】室温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10 mol·L-1的CH3COOH 溶液和HCN溶液所得滴定曲线如图所示。下列说法正确的是
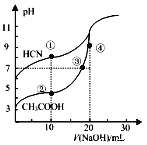
A. 当加入10mLNaOH时:c(CH3COOH)>c(HCN)
B. 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C. 已知室温下某碱AOH的Kb=1×10-9,则ACN的水溶液呈碱性
D. 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.ⅥA族元素中氢化物最稳定的其沸点一定最高
B.醋酸铵是含有极性键的共价化合物
C.离子化合物中不可能含有非极性共价键
D.二氯甲烷分子为正四面体结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题。
(1)下列物质能导电且属于电解质的是________(填序号)。
A. 固态氯化镁(MgCl2) B. 液态氯化镁(MgCl2)
C. 氯化钠溶液D. 铝
(2)写出下列物质在水溶液中的电离方程式:
①Na2CO3______________;
②H2SO4______________;
③KHSO4_____________。
(3)有人说可将无机化合物KHSO4与NaHCO3归为同一类别,你认为他的理由主要是_____;有人说可将无机化合物KHSO4与H2SO4归为同一类别,你认为他的理由主要是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学家一直致力于对化学反应进行的方向、限度和速率进行研究,寻找合适理论对其进行解释。
I.为了治理汽车尾气污染(含有NO、CO、烃类等),科学家设计在汽车排气管上装上催化剂发生如下反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。某温度下,向体积为1L的密闭容器中充入NO、CO各0.1mol,平衡时NO的转化率为60%,计算该反应的平衡常数K=______________;此反应常温下能够自发进行的原因是_______________________。
N2(g)+2CO2(g)。某温度下,向体积为1L的密闭容器中充入NO、CO各0.1mol,平衡时NO的转化率为60%,计算该反应的平衡常数K=______________;此反应常温下能够自发进行的原因是_______________________。
Ⅱ.右图是高锰酸钾酸性溶液与草酸发生反应的有关图象,溶液体积为500mL。
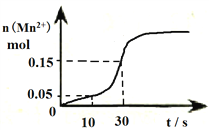
(1)该反应在10-30s的化学反应速率v(Mn2+)=________________________。
(2)请写出该反应的离子方程式____________________________________________________。
(3)观察图象说明在一定温度下反应速率起始缓慢然后加快的原因______________________。
Ⅲ. 难溶电解质FeS在水溶液中存在着溶解平衡:FeS(s)![]() Fe2+(aq) + S2-(aq),在一定温度下,Ksp=c(Fe2+)·c(S2-)=6.25×10-18;在该温度下,氢硫酸饱和溶液中存在c2(H+)· c(S2-)=1.0×10-22。将适量FeCl2投入氢硫酸饱和溶液中,欲使溶液中c(Fe2+)=1.0 mol·L-1,应调节溶液的c(H+)=_______。
Fe2+(aq) + S2-(aq),在一定温度下,Ksp=c(Fe2+)·c(S2-)=6.25×10-18;在该温度下,氢硫酸饱和溶液中存在c2(H+)· c(S2-)=1.0×10-22。将适量FeCl2投入氢硫酸饱和溶液中,欲使溶液中c(Fe2+)=1.0 mol·L-1,应调节溶液的c(H+)=_______。
IV.氢硫酸中H2S是分步电离的,H2S![]() H+ + HS- K1=1.3×10-7,HS-
H+ + HS- K1=1.3×10-7,HS-![]() H+ + S2- K2=7.1×10-15欲使溶液中c(S2-)浓度增大,应采取的措施有_____________。
H+ + S2- K2=7.1×10-15欲使溶液中c(S2-)浓度增大,应采取的措施有_____________。
A.加入NaOH B.加入CuSO4 C.适当降低温度 D.通入过量SO2 E.加入Na2CO3 (H2CO3电离常数K1=4.4×10-7,K2=4.7×10-11)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汉黄芩素是传统中草药黄芩的有效成分之一,对肿瘤细胞的杀伤有独特作用。下列有关汉黄芩素的叙述正确的是( )
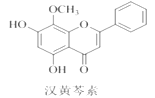
A. 汉黄芩素的分子式为C16H13O5
B. 与足量H2发生加成反应后,该分子中官能团的种类减少1种
C. 1 mol该物质与溴水反应,最多消耗1 mol Br2
D. 该物质遇FeCl3溶液显紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氰化钠(NaCN)是一种化工原料,用于基本化学合成、电镀、冶金和有机合成医药、农药及金属处理等方面。氰化钠同时也是一种剧毒物质,严重危害人类健康,一旦泄露需要及时处理。
(1)已知25℃时,相同物质的量浓度的NaHCO3、NaCN、Na2CO3溶液pH依次增大,则向NaCN溶液中通入少量CO2,发生反应的离子方程式是________。
(2)若氰化钠泄漏,可以通过喷洒双氧水或硫代硫酸钠溶液来处理,以减轻污染。
①常温下,氰化钠能与过氧化氢溶液反应,生成一种酸式盐和一种能使湿润的红色石蕊试纸变成蓝色的气体,大大降低其毒性。写出该反应的离子方程式 _____________;
②已知:氰化钠与硫代硫酸钠的反应是NaCN+Na2S2O3=NaSCN+Na2SO3,当1.96gNaCN完全反应时转移的电子物质的量是__________;实验室中硫氰化钠可以代替硫氰化钾检验______________。
(3)现要检测某经过处理过的废水中氰化钠的含量。已知:废水中氰化钠最高排放标准是0.50mg/L;Ag++2CN—=[Ag(CN)2]—(无色溶液),Ag++I—=AgI↓,CN—优先与Ag+反应。
实验如下:取30.00mL处理后的氰化钠废水于锥形瓶中,并滴加几滴KI溶液作指示剂;用1.00×10—4mol·L—1的标准AgNO3溶液滴定,达到滴定终点时,消耗AgNO3溶液的体积为1.50mL。(假设废水中没有其它成分参与反应。)
①滴定达到终点时的现象是____________________________________;
②该废水________(填“能”或“不能”)直接排放到河流中,通过计算结果说明得出上述结论的依据:____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com