

| A、原溶液中c(Fe3+)=0.2mol?L-1 |
| B、要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氨水,在加KSCN溶液,溶液呈血红色,则含有Fe2+ |
| C、SO42-、NH4+、Na+一定,CO32-、Al3+一定不存在 |
| D、溶液中至少有4种离子存在,其中Cl-一定存在,且c(Cl-)≥0.2mol?L -1 |
| 0.06mol-0.04mol |
| 0.1L |


 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案科目:高中化学 来源: 题型:
| A、X的氢化物溶于水生成弱酸 |
| B、Z的氢化物的水溶液在空气中存放不易变质 |
| C、Y与X可生成Y3X2型化合物 |
| D、Z的单质在氧气中燃烧可以生成两种酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 物质中铁含量的测定方法是多种多样的.
物质中铁含量的测定方法是多种多样的. )结合显橙红色,再用比色法测定.其中涉及以下反应:4FeCl3+2NH2OH?HCl═4FeCl2+N2O↑+6HCI+H2O
)结合显橙红色,再用比色法测定.其中涉及以下反应:4FeCl3+2NH2OH?HCl═4FeCl2+N2O↑+6HCI+H2O 和邻啡罗啉都是含氮的有机物,l mol吡啶中含有Q键的物质的量为
和邻啡罗啉都是含氮的有机物,l mol吡啶中含有Q键的物质的量为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用含0.1mol FeCl3的溶液与足量沸水反应制得的Fe(OH)3胶体中胶粒数为0.1NA |
| B、46g NO2和N2O4的混合气体中含N原子总数为NA |
| C、标准状况下,5.6L CCl4含有的分子数为0.25NA |
| D、等物质的量的NH4+和OH-含电子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、硫化氢易溶于水,可做喷泉实验 |
| B、硫化氢是一种弱酸,它具有酸的通性 |
| C、硫化氢燃烧时,发出淡蓝色火焰 |
| D、硫化氢受热易分解生成两种单质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 2014年诺贝尔化学奖授予超高分辨率荧光显微镜的贡献者.人类借助于这种显微镜可以观察到单个的蛋白质分子.下列有关叙述不正确是
2014年诺贝尔化学奖授予超高分辨率荧光显微镜的贡献者.人类借助于这种显微镜可以观察到单个的蛋白质分子.下列有关叙述不正确是| A、蛋白质中含有碳、氢、氧、氮等元素 |
| B、蛋白质属于高分子化合物 |
| C、蛋白质可完全水解生成氨基酸 |
| D、消毒过程中细菌蛋白质发生了盐析 |
查看答案和解析>>
科目:高中化学 来源: 题型:
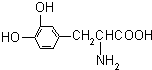 L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如图:
L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如图:| A、既没有酸性,又没有碱性 |
| B、既具有酸性,又具有碱性 |
| C、只有酸性,没有碱性 |
| D、只有碱性,没有酸性 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 编号 | 叙述I | 叙述II |
| A | 金属活动性铜比铁弱 | 镀铜铁制品表层划损后仍然受到保护 |
| B | 金属钠有还原性 | 用金属钠检验无水乙醇中是否含有少量水 |
| C | Ksp(CaCO3)<Ksp(CaSO4) | 用Na2CO3溶液和盐酸除水垢CaSO4 |
| D | Cl2具有漂白性 | 用氯气制盐酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com