
【题目】工业上以浓缩海水为原料提取溴的部分流程如下:

下列说法正确的是( )
A. 海水需要浓缩,是因为海水中的Br2含量较低
B. 热空气的作用是将多余的Cl2吹出
C. 反应釜2中发生的反应是5Br-+BrO3-+3H2O=3Br2+6OH-
D. 吸收塔中发生的反应是3Br2+3CO32-=5Br-+BrO3-+3CO2
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D、E、F为周期表中前四周期的七种元素,它们的原子序数依次增大。A是周期表中原子半径最小的元素;B的基态原子有3个不同的能级,各能级中电子数相等;D的基态原子2p能级上未成对电子数与B原子的相同;D2-离子与E2+离子具有相同的稳定电子层结构;F有“生物金属”之称,F4+离子和氩原子的核外电子排布相同。
请回答下列问题:
(1)D元素的原子中存在________种运动状态的电子;
(2)在A元素与上述其他元素形成的分子中,其中心原子为sp3杂化的为________(写出2种即可)
(3)与C同族且位于第四周期元素所形成简单气态氢化物的电子式为________;其与C的简单气态氢化物相比稳定性更________(填“强”或“弱”);
(4)F的基态原子核外电子排布式是_____________________________;其在元素周期表中的位置是:_______________________________;
(5)E原子的第一电离能比同周期后面相邻元素的第一电离能________(填“大”或“小”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用下列各组物质序号填空:
① O2和O3 ; ② 12C、13C、14C; ③ C2H6和C5H12; ④C3H6和C5H10;⑤14N、14C
⑥ ![]() 和
和![]() ;⑦ CH3 (CH2) 3 CH3和
;⑦ CH3 (CH2) 3 CH3和![]()
互为同位素的是______; 互为同素异形体的是_______ ; 互为同系物的是_______;互为同分异构体的是_______ ;属于同一物质的是 _______ 。
(2)除去溴苯中的溴:试剂是:________,反应的化学方程式为____________________
(3)一定质量的乙醇在氧气不足时燃烧,得到CO、CO2和H20质量共为27.6g,若H2O的质量为10.8g,则CO2的质量为_____________g
(4)2g C2H2完全燃烧生成液态水和CO2,放出99.6kJ热量,则C2H2燃烧热的热化学方程式:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容条件下,能说明可逆反应:H2(g)+I2(g)![]() 2HI(g)达到平衡状态的是
2HI(g)达到平衡状态的是
A. v(H2)正=2v(HI)逆B. 气体的颜色保持不变
C. 气体的密度保持不变D. 气体的压强保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:① CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) ΔH1=a kJ·mol-1
② C(s)+O2(g)=CO2(g) ΔH2=b kJ·mol-1
③ 2H2O(l)=2H2(g)+O2(g) ΔH3=c kJ·mol-1
④ 2C(s)+2H2(g)+O2(g)=CH3COOH(l) ΔH4=d kJ·mol-1 下列说法正确的是
A. 使用催化剂,ΔH1减小 B. b>0
C. H2(g)+![]() O2(g)=H2O(l) ΔH=
O2(g)=H2O(l) ΔH=![]() kJ·mol-1 D. d=2b-c-a
kJ·mol-1 D. d=2b-c-a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中一定能大量共存的是
A. 能使甲基橙变红的溶液:Na+、NH4+、NO3-、CO32-
B. 加入苯酚显紫色的溶液:K+、NH4+、Cl-、SCN-
C. 常温下,![]() =1×10-14的溶液:K+、Na+、AlO2-、CO32-
=1×10-14的溶液:K+、Na+、AlO2-、CO32-
D. 加入Al能放出大量H2的溶液:Na+、Fe2+、NO3-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在一定条件下,CO的燃烧热为283 kJ/mol,CH4的燃烧热为890 kJ/mol,由1 mol CO和3 mol CH4组成混合气体在上述条件下充分燃烧,释放的热量为
A. 2912 kJ B. 2953 kJ C. 3236 kJ D. 3867 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气既是高效洁净的能源,又是重要的化工原料,在生产、生活中用途广泛。
(1)已知25℃、101kPa时,1 g甲烷不完全燃烧生成CO和液态水时放出37.96 kJ热量,则该条件下反应2CH4(g)+3O2(g)=2CO(g)+4H2O(l)的ΔH=______kJ·mol-1
(2)甲烷可以消除氮氧化物污染。如:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g)
①下列措施能够使该反应速率加快的是______。
a.使用催化剂 b.降低温度 c.及时分离水
②若上述反应在恒容的密闭容器中进行,下列叙述中不能说明该反应已达平衡状态的是______。
a.容器内气体的压强不再变化 b.混合气体的质量不再变化
c.c(NO2) = 2c(N2) d.单位时间内生成1molCO2,同时生成2molNO2
(3)甲烷可直接应用于燃料电池,该电池采用可传导O2-的固体氧化物为电解质,其工作原理如图所示:
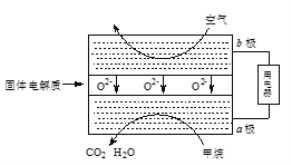
①外电路电子移动方向:____。(填“a极到b极”或“b极到a极”)。
②b极电极反应式为______。
③若燃料电池消耗的空气在标准状况下的体积是5.6L(假设空气中O2体积分数为20%),则理论上消耗甲烷______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】48mL 0.1mol·L-1的Na2SO3溶液恰好与40mL 0.04mol·L-1的K2Cr2O7(重铬酸钾)溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则Cr在还原产物中的化合价为( )
A.+2B.+3C.+4D.+5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com