

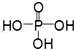
 )
)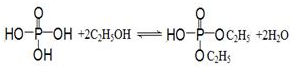 .
. .
. 分析 (1)由图可知仪器a为球形冷凝管(或冷凝管);
(2)加热液体易发生剧烈沸腾,加沸石可防止暴沸,若加热后发现未加沸石,要先冷却;
(3)乙醇发生消去反应生成乙烯;
(4)乙醇和磷酸反应生成磷酸二乙酯、水,为酯化反应;
(5)乙醇易挥发,乙醇、乙烯均能被高锰酸钾氧化;
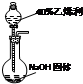
(6)用乙烯利溶液和NaOH固体制取乙烯,利用固体与液体反应不加热装置,需要分液漏斗、烧瓶等.
解答 解:(1)仪器a的名称为球形冷凝管(或冷凝管),故答案为:球形冷凝管(或冷凝管);
(2)在三颈瓶中加入沸石的作用是防暴沸;若加热后发现未加沸石,应采取的正确方法是停止加热,冷却后加入,
故答案为:防暴沸;停止加热,冷却后加入;
(3)用化学反应方程式表示上述制备乙烯的原理为C2H5OH$→_{P_{2}O_{5}}^{80℃-160℃}$CH2=CH2↑+H2O,为消去反应,
故答案为:C2H5OH$→_{P_{2}O_{5}}^{80℃-160℃}$CH2=CH2↑+H2O;
(4)乙醇和磷酸反应生成磷酸二乙酯、水,为酯化反应,反应为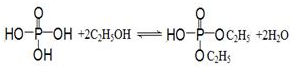 ,
,
故答案为: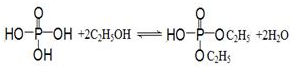 ;
;
(5)用上述装置验证产生了乙烯不够严密,理由是没有排除乙醇的干扰(或在通过酸性高锰酸钾溶液之前,应该除去乙醇),
故答案为:没有排除乙醇的干扰;
(6)用乙烯利溶液和NaOH固体制取乙烯,利用固体与液体反应不加热装置,需要分液漏斗、烧瓶等,装置简图为 ,
,
故答案为: .
.
点评 本题考查有机物的制备实验,为高频考点,把握制备原理、有机物的性质、实验技能为解答的关键,侧重分析与实验能力的考查,题目难度中等.


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案科目:高中化学 来源: 题型:解答题
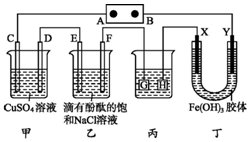 如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.
如图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极.将直流电源接通后,F极附近呈红色.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
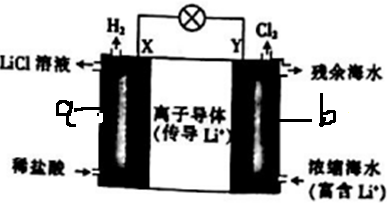
| A. | 电池工作时,Li+通过离子导体移向b区 | |
| B. | 电流由X极通过电路移向Y极 | |
| C. | 正极发生的反应为2H++2e-═H2↑ | |
| D. | Y极每生成1molCl2,a区得到2molLiCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中电能转化为化学能 | |
| B. | 反应②使用催化剂,△H2减小 | |
| C. | 反应③中反应物的总能量高于生成物的总能量 | |
| D. | 反应CH4(g)=C(s)+2H2(g)的△H=+74.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | Ba(OH)2溶液与H2SO4溶液反应:Ba2++2H++2OH-+SO42-═BaSO4↓+2H2O | |
| C. | Na2CO3溶液与稀硝酸反应:CO32-+2H+═CO2↑+H2O | |
| D. | NH4Cl 溶液显酸性:NH4++H2O?NH3•H2O+H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,砷属于p区元素.
,砷属于p区元素.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com