
【题目】工业上从含有Cr2O72﹣和Cr3+的废水中回收铬的工艺流程如图所示: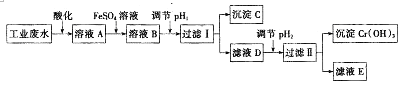
己知:①2CrO42﹣(黄色)+2H+Cr2O72﹣(橙色)+H2O;
②常温下,Ksp[(Fe(OH)3]=4.0×10﹣38;Ksp[(Cr(OH)3]=1.0×10﹣32
③当离子浓度小于1.0×10﹣5molL﹣1时,认为沉淀完全
请回答下列问题:
(1)酸化后的溶液A显色.
(2)配制FeSO4溶液时,除了加水外还需要加入的试剂是(填试剂名称).
(3)向溶液A中加入FeSO4溶液发生反应的离子方程式为 .
(4)沉淀C的化学式为 , 要使Cr3+沉淀完全pH2值至少为 .
【答案】
(1)橙
(2)铁粉、硫酸
(3)Cr2O72﹣+6Fe2++14H+=2Cr3++6Fe3++7H2O
(4)Fe(OH)3,5
【解析】解:(1)因为2CrO42﹣(黄色)+2H+Cr2O72﹣(橙色)+H2O,所以酸化平衡正向移动,则酸化后的溶液A显橙色;
所以答案是:橙;
(2)防止亚铁离子氧化,并抑制水解,则配制FeSO4溶液时,需加入少量铁粉和稀硫酸,
所以答案是:铁粉、硫酸;
(3)依据分析可知:溶液A含有Cr2O72﹣,具有强氧化性,能氧化亚铁离子为铁离子,离子反应方程式为:Cr2O72﹣+6Fe2++14H+=2Cr3++6Fe3++7H2O,
所以答案是:Cr2O72﹣+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(4)根据以上分析,沉淀C的化学式为Fe(OH)3;当离子浓度小于1.0×10﹣5 molL﹣1时,认为沉淀完全,故铬离子完全沉淀时有:1×10﹣5×c(OH)3=1.0×10﹣32,解得c(OH)= ![]() =10﹣9,即pH≥5完全沉淀,所以要使Cr3+沉淀完全pH2值至少为5,
=10﹣9,即pH≥5完全沉淀,所以要使Cr3+沉淀完全pH2值至少为5,
所以答案是:Fe(OH)3;5.


科目:高中化学 来源: 题型:
【题目】图1是铜锌原电池示意图,图2中轴表示实验时流入正极的电子的物质的量, y轴表示

A. 铜棒的质量 B. c(H+) C. c(SO42-) D. c(Zn2+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C为三种常见的单质,能发生如图1所示的转化关系,B的一种同素异形体的晶胞如图2所示。

回答下列问题:
(1)形成A的元素在周期表中的位置是__________________________________,A对应的基态原子的价电子排布为_____________________。
(2)在B单质对应的基态原子中,核外存在___________对自旋方向相反的电子。
(3)写出Y的一种常见等电子体分子的结构式__________________________;两者相比较沸点较高的是__________(填化学式);Y分子中B对应原子的杂化方式为_________________。
(4)配合物A(Y)x常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断A(Y)x晶体属于________________(填晶体类型)。A(Y)x的中心原子价电子数与配体提供的电子数之和为18,则x=__________。A(Y)x在一定条件下发生反应A(Y)x (s) ![]() A (s) + x Y (g),已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型是_____________。
A (s) + x Y (g),已知反应过程中只断裂配位键,由此判断该反应所形成的化学键类型是_____________。
(5)在图2晶胞中,每个晶胞平均占有__________个原子,若距离最近的两个原子的距离为L cm,晶胞边长为a cm,根据硬球接触模型,则L=_________a,晶胞的密度ρ=___________g·cm-3(用含a、NA代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从植物花朵中提取到一种色素,它实际上是一种有机弱酸,可用HR表示,HR在盐酸溶液中呈现红色,HR在NaOH溶液中呈现蓝色,将HR加入浓硝酸中呈现红色,微热后溶液的红色褪去,根据以上现象,可推测( )
A.HR应为红色 B.HR应为蓝色
C.R-应为无色 D.R- 应为红色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来“雾霾”污染日益严重,原因之一是机动车尾气中含有NO、NO2、CO等气体,火力发电厂释放出大量的NOx、SO2和CO2等气体也是其原因,现在对其中的一些气体进行了一定的研究:
(1)用 CH4催化还原氮氧化物可以消除氮氧化物的污染.
已知:①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=﹣574 kJ/mol
②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=﹣1160 kJ/mol
③H2O(g)═H2O(l)△H=﹣44.0 kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式: .
(2)用活性炭还原法可以处理氮氧化物.某研究小组向某密闭容器加入一定量的活性炭和NO,发生反应C(s)+2NO(g)N2(g)+CO2(g)△H=akJmol﹣1 .
在T1℃时,反应进行到不同时间测得各物质的浓度如表:
| 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
①根据图表数据分析T1℃时,该反应在0﹣20min的平均反应速率V(NO)=;计算该反应的平衡常数K=;
②30min后,只改变某一条件,根据上表中的数据判断改变的条件可能是(填字母编号).
A.通人一定量的CO2 B.加入合适的催化剂 C.适当缩小容器的体积
D.通人一定量的NO E.加入一定量的活性炭
③若50min后升高温度至T2℃,达到平衡时,容器中NO、N2、CO2的浓度之比为2:1:1,则达到新平衡时NO的转化率(填“升高”或“降低”),a 0(填“>”或“<”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质N2、H2O、Na2O2、CaCl2、KOH、NaF中,既含有离子键,又含有共价键的物质是_______,属于共价化合物的是__________。
(2)用电子式表示CaCl2的形成过程: __________。
(3)氮化钠(Na3N)是科学家制备的种重要化合物,它与水作用产生NH3。请写出Na3N的电子式是__________。
(4)Na3N与盐酸反应生成两种盐,反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】pH=2.1 的两种酸溶液 A、B 各 1mL,分别加水稀释到 100mL,其 pH 与溶液体积的关系如图,下列说法不正确的是( )
A.若 a<4.1,则 A、B都是弱酸
B.
C.
D.
A.若 a<4.1,则 A、B都是弱酸
B.稀释后,A 酸溶液的酸性比B酸溶液强
C.若 a=4.1,则 A 是强酸,B是弱酸
D.A、B两种酸溶液的物质的量浓度一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物E是医药合成中间体。其合成路线如下:

(1)![]() 的官能团名称为_____________。E的分子式为_______________。
的官能团名称为_____________。E的分子式为_______________。
(2)B→D的过程中,B分子的羧基全部酯化,写出该反应方程式:_________________。
(3)D→E的反应历程如下:

写出反应Ⅱ、Ⅲ的反应类型:Ⅱ_____________、Ⅲ_____________
(4)写出满足下列条件的A的所有同分异构体的结构简式___________________。
a.能与新制氢氧化铜悬浊液反应产生砖红色沉淀
b.常温下能与Na2CO3反应并释放出气体
(5)请写出以CH2=CH2为主要原料(无机试剂任用)制备OHC—CHO(乙二醛)的合成路线流程图(须注明反应条件)_______。(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如右图所示。

若“重整系统”发生的反应中![]() =6,则FexOy的化学式为_________________,“热分解系统”中每分解lmolFexOy,转移电子的物质的量为________________________。
=6,则FexOy的化学式为_________________,“热分解系统”中每分解lmolFexOy,转移电子的物质的量为________________________。
(2)二氧化碳催化加氢合成低碳烯烃是目前研究的热门课题。
在一个2L密闭恒容容器中分别投入1.5molCO2、5.0molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右图所示。
C2H4(g)+4H2O(g) ΔH;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右图所示。

①该反应的ΔH_________0 (填“>”“<”或“不能确定”);
②在TA温度下的平衡常数K=__________________。
③提高CO2的平衡转化率,除改变温度外,还可采取的措施是:_______________________ (列举一项)。
④在TA温度下,其他条件不变,起始时若按1molCO2、2molH2、 lmolC2H4(g)、2molH2O(g)进行投料,此时v(正)________v(逆)。(填“>”“<”或“=”)。
(3) 用氨水吸收CO2制化肥碳铵(NH4HCO3)。
①已知:NH3·H2O(aq)![]() NH4+(aq)+OH-(aq) ΔH1= a kJ/mol
NH4+(aq)+OH-(aq) ΔH1= a kJ/mol
CO2(g)+H2O(1)![]() H2CO3(aq) ΔH2= b kJ/mol
H2CO3(aq) ΔH2= b kJ/mol
H2CO3(aq)+OH-(aq)![]() HCO3-(aq) +H2O(1) ΔH3= c kJ/mol
HCO3-(aq) +H2O(1) ΔH3= c kJ/mol
则利用NH3·H2O吸收CO2制备NH4HCO3的热化学方程式为____________________________;
②己知常温下相关数据如表:
Kb(NH3·H2O) | 2×10-5 |
Ka1(H2CO3) | 4×10-7 |
Ka2(H2CO3) | 4×10-11 |
则反应NH4++ HCO3-+H2O![]() NH3·H2O +H2CO3的平衡常数K=________________。
NH3·H2O +H2CO3的平衡常数K=________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com