
硫化钠是一种重要的化工原料。工业上用硫酸钠与碳反应得到硫化钠。反应方程式如下:
Na2SO4 + 2C Na2S + CO2↑
Na2S + CO2↑
完成下列填空:
(1)上述反应的元素中,原子半径最小的元素的原子有 种能级不同的电子。
(2)下列可以证明二氧化碳是非极性分子的事实是 (填编号)
a.二氧化碳密度比空气大
b.二氧化碳能溶于水
c.二氧化碳在电场中通过不偏向
d.二氧化碳常温常压下为气态
(3)硫化钠在一定条件下会与硫单质反应生成多硫化钠(Na2SX)。在碱性溶液中,Na2SX与NaBrO3反应生成Na2SO4与NaBr。若Na2SX与NaBrO3反应的物质的量之比为3:16,则 x = 。
(4)写出硫氢化钠与少量硫酸铜溶液反应的离子方程式 。能否用硫酸铜溶液来鉴别硫化钠溶液和硫氢化钠溶液?请简述实验操作和现象并说明自己的观点: 。
(5)已知:H2S Ki1 = 9.1×10-8 Ki2 = 1.1×10-12 HF Ki = 3.5×10-4
H2SO3 Ki1 = 1.5×10-2 Ki2 = 1.0×10-7 HAc Ki = 1.75×10-5
若用右图的装置,用硫化钠固体和下列溶液制取硫化氢气体,可选用的试剂是 。
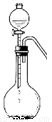
a.硝酸 b.亚硫酸氢钠 c.氢氟酸 d.醋酸
科目:高中化学 来源:2016届山西省高三上学期11月半月考试化学试卷 (解析版) 题型:填空题
高锰酸钾(KMnO4)和过氧化氢(H2O2)是两种典型的氧化剂。
(1)H2O2的结构式为________________。
(2)下列物质中能使酸性KMnO4溶液褪色的是________(填选项字母)。
A.臭碱(Na2S) B.小苏打(NaHCO3) C.水玻璃(Na2SiO3) D.酒精(C2H5OH)
(3)高锰酸钾、双氧水、活性炭常用于饮用水的处理,但三者联合作用时必须有先后顺序。
①在稀硫酸中,KMnO4和H2O2能发生氧化还原反应:
氧化反应:H2O2-2e-→2H++O2↑
还原反应:MnO4-+5e-+8H+→Mn2++4H2O
写出该氧化还原反应的离子方程式________________________________________。
②在处理饮用水时,活性炭应在高锰酸钾反应结束后投加,否则会发生反应:
4KMnO4+3C+H2O=4MnO2+2X+K2CO3,其中X的化学式为________。
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上学期第四次质检化学试卷(解析版) 题型:选择题
下列说法正确的是 (NA表示阿伏加德罗常数的值)
A.标准状况下,以任意比例混合的甲烷和乙烯混合物22.4 L充分燃烧,生成物中水的分子数为2NA
B.标准状况下,11.2L辛烷完全燃烧后,所生成气态产物的分子数为4NA
C.常温常压下,1mol苯中含有3NA碳碳双键、3NA碳碳单键
D.常温常压下,1 mol甲烷和1mol氯气光照反应生成2NA个气体分子
查看答案和解析>>
科目:高中化学 来源:2016届陕西省高三上学期期中化学试卷(解析版) 题型:选择题
下列各反应中,氧化反应与还原反应在同种元素中进行的是
A.Cl2+2NaOH===NaCl+NaClO+H2O
B.2KClO3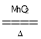 2KCl+3O2↑
2KCl+3O2↑
C.2KMnO4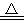 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
D.2H2O 2H2↑+O2↑
2H2↑+O2↑
查看答案和解析>>
科目:高中化学 来源:2016届上海市十一校高三上学期12月联考化学试卷(解析版) 题型:推断题
优良的有机溶剂对孟烷、耐热型特种高分子功能材料PMnMA的合成路线如下:
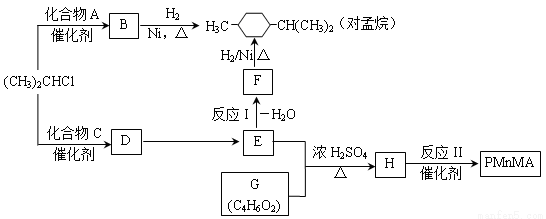
己知芳香化合物苯环上的氢原子可被卤代烷中的烷基取代。如:
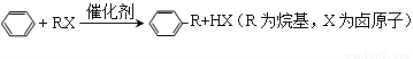
Ⅰ B为芳香烃。
(1)由B生成对孟烷的反应类型是 。
(2)(CH3)2CHCl与A生成B的化学方程式是 。
(3)A的同系物中相对分子质量最小的物质是 (填写名称)。
Ⅱ 1.08g的C与足量饱和溴水完全反应生成3.45 g白色沉淀。E不能使Br2的CC14溶液褪色。
(1)F的官能团是 。
(2)C的结构简式是 。
(3)反应I的条件是 。
(4)下列说法正确的是(选填字母) 。
a.B可使酸性高锰酸钾溶液褪色
b.C不存在醛类同分异构体
c.D的酸性比E弱
d.E的沸点高于对孟烷
(5)G有三种不同环境的H原子,且个数比为3:2:1。G能与NaHCO3溶液反应放出CO2。反应II的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源:2016届上海市十一校高三上学期12月联考化学试卷(解析版) 题型:选择题
短周期元素X、Y、Z、W 的原子序数依次增大,且原子最外层电子数之和为13。X 的原子半径比Y 的小,X 与W 同主族,Z 是地壳中含量最高的元素。下列判断合理的是
A.元素W分别与X、Y、Z形成的化合物都是离子化合物
B.四种元素简单离子的半径:X < Y < Z < W
C.Z与其他三种元素形成的常见化合物中有离子晶体、原子晶体和分子晶体
D.只含X、Y、Z 三种元素的化合物,可能是离子化合物,也可能是共价化合物
查看答案和解析>>
科目:高中化学 来源:2016届上海市十一校高三上学期12月联考化学试卷(解析版) 题型:选择题
常温下,下列各组离子一定能在指定溶液中大量共存的是
A.使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl-
B.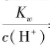 =1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
=1×10-13mol·L-1的溶液中:NH4+、Ca2+、Cl-、NO3-
C.与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42-
D.水电离的c(H+)=1×10-13mol·L-1的溶液中:K+、Na+、AlO2-、CO32-
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省宜春市高一上学期第三次月考化学试卷(解析版) 题型:计算题
将6 g的铁粉加入200 mL Fe2(SO4)3和CuSO4的混合溶液,充分反应得到200 mL0.5mol /L FeSO4溶液和5.2 g固体沉淀物。求:
(1)反应后固体的成分及其质量; (2)原混合溶液中Fe3+的浓度。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年浙江省桐乡市高二上期中(普通班)化学试卷(解析版) 题型:填空题
二甲醚(DME)一种清洁的替代燃料,不含硫,不会形成微粒,而且与汽油相比,排放的NO2更少,因此是优良的柴油机替代燃料。工业上利用一步法合成二甲醚的反应如下(复合催化剂为CuO/ZnO/Al2 O2):2CO( g)+4H2(g)
g)+4H2(g) CH3OCH3(g)+H2O(g) △H=-204.7kJ/mol。
CH3OCH3(g)+H2O(g) △H=-204.7kJ/mol。
(1)600℃时,一步法合成二甲醚过程如下:
CO(g)+2H2(g)=CH3OH(g) △H1=-100.46kJ/mol
2CH3OH(g)=CH3OCH3(g)+H2O(g) △H2
CO(g)+H2O(g)=CO2(g)+H2(g) △H3=-38.7kJ/mol
则△H2= 。
(2)以DME为燃料,氧气为氧化剂,在酸性电解质溶液中用惰性电极制成燃料电池,则通入氧气的电极是电源的 (填正、负)极,通DME的电极反应为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com