
| A. | BaCl2溶液 | B. | K2SO4溶液 | C. | CuSO4 | D. | NH4NO3溶液 |
分析 金属钠遇水先发生反应,生成氢氧化钠并放出氢气:2Na+2H2O=2NaOH+H2↑,NaOH与CuSO4溶液反应会生成Cu(OH)2蓝色沉淀,与NH4NO3溶液反应会生成一水合氨和硝酸钠.
解答 解:A、金属钠先和BaCl2溶液中的水反应生成氢氧化钠并放出氢气:2Na+2H2O=2NaOH+H2↑,但是生成的氢氧化钠和氯化钡不反应,即只有气体生成,故A错误;
B、金属钠先和硫酸钾溶液中的水反应生成氢氧化钠并放出氢气:2Na+2H2O=2NaOH+H2↑,但是生成的氢氧化钠和硫酸钾不反应,只有气体生成,故B错误;
C、Na首先和水反应生成氢氧化钠并放出氢气:2Na+2H2O=2NaOH+H2↑,NaOH与CuSO4溶液反应会生成Cu(OH)2蓝色沉淀,既有沉淀析出,又有气体逸出,故C正确;
D、Na首先和水反应生成氢氧化钠并放出氢气:2Na+2H2O=2NaOH+H2↑,NaOH与NH4NO3溶液反应会生成一水合氨和硝酸钠,没有沉淀生成,只有气体生成,故D错误.
故选C.
点评 本题关键要知道Na首先和水反应生成氢氧化钠并放出氢气,主要看NaOH是否与选项中的溶液反应生成沉淀.


科目:高中化学 来源: 题型:选择题
| A. | 8倍 | B. | 12倍 | C. | 24倍 | D. | 64倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应的焓变为正值 | |
| B. | K表达式中,C(SO3)指反应在该条件下达到化学平衡时SO3的物质的量浓度 | |
| C. | 升高温度,逆反应速率减小 | |
| D. | 该反应化学方程式为:NO+SO3?NO2+SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
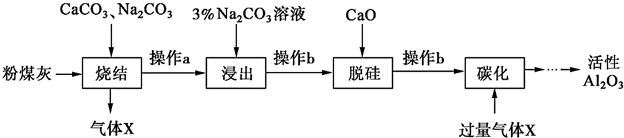
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
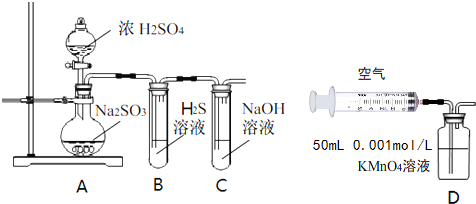
| 实验步骤 | 实验操作 | 预期现象与结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
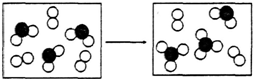 A、B、C、D、E、F是原子序数依次增大的短周期元素,B是短周期中金属性最强的元素,C是地壳中含量最高的金属元素,D单质的晶体是良好的半导体材料,E的最外层电子数与内层电子数之比为3:5,A与E同族.
A、B、C、D、E、F是原子序数依次增大的短周期元素,B是短周期中金属性最强的元素,C是地壳中含量最高的金属元素,D单质的晶体是良好的半导体材料,E的最外层电子数与内层电子数之比为3:5,A与E同族.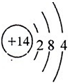
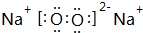 .
. Al(OH)3﹢3H+,生氢氧化铝胶体,能吸附水中悬浮物,使之凝聚达到净水目的
Al(OH)3﹢3H+,生氢氧化铝胶体,能吸附水中悬浮物,使之凝聚达到净水目的查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com