
| A. | Na+ Cl- Mg2+ SO42- | B. | K+ Cu2+ I- SO42- | ||
| C. | NO3- K+ Cl- OH- | D. | Al3+ Na+ S2- Cl- |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温下,醋酸钠与醋酸的混合溶液pH=7,c(Na+)=c(CH3COO-) | |
| B. | 常温下,将pH=1的醋酸溶液稀释100倍后,水电离的c(H+)=10-11mol/L | |
| C. | 0.1 mol/L Na2CO3溶液中:c(OH-)=c(HCO3-)+c(H+)+2c(H2CO3) | |
| D. | 0.1mol/L NaHCO3溶液中:c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
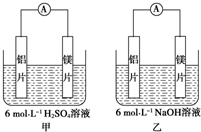 甲、乙两位学生想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6mol•L-1H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.
甲、乙两位学生想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6mol•L-1H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向碳酸氢钙溶液中加入过量氢氧化钠:Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32- | |
| B. | 氧化铁可溶于氢碘酸:Fe2O3+6H+=2Fe3++3H2O | |
| C. | Fe3+的检验:Fe3++3SCN-=Fe(SCN)3↓ | |
| D. | Na2S溶液呈碱性:S2-+H2O=HS-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液呈黄绿色,且具有刺激性气味,说明Cl2的存在 | |
| B. | 加入有色布条,有色布条褪色,说明溶液中有Cl2存在 | |
| C. | 加入NaHCO3溶液,有无色气体产生,说明有HClO存在 | |
| D. | 先加入盐酸酸化,再加AgNO3溶液产生白色沉淀,说明有Cl-存在 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com