
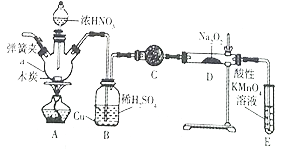
【题目】亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。实验室用如图所示装置制备亚硝酸钠。请回答下列问题:
已知:①3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O
②酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+
(1)仪器a的名称是_____________。
(2)B装置中的主要现象是_______。C中的试剂可以是____________。
(3)D中反应生成NaNO2的化学方程式为_______。E装置的作用是______________。
(4)检验D装置中生成NaNO2
操作 | 现象 | 结论 |
_____________ | ____________ | 有NaNO2生成 |
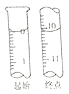
(5) NaNO2有毒,国家规定肉制品中NaNO2含量不能超过30mg/kg。从1000g隔夜熟肉中提取NaNO2后,配成溶液,再用0.0050mol/L的酸性高锰酸钾溶液滴定,滴定起始和终点的液面位置如图所示,计算隔夜熟肉中NaNO2的含量是_______mg/kg。
【答案】 三颈烧瓶 铜片溶解,溶液变为蓝色 碱石灰 2NO+Na2O2=2NaNO2 吸收尾气,防止污染 取少量生成物溶于稀硫酸 产生无色气体并在液面上方变为红棕色 8.7
【解析】(1)仪器a的名称是三颈烧瓶,正确答案:三颈烧瓶。
(2) 装置B中发生的反应是:A装置生成的二氧化氮进入装置B中,二氧化氮与水反应生成了硝酸,方程式为3NO2+H2O=2HNO3+NO,硝酸和铜反应生成硝酸铜、一氧化氮和水,所以反应现象为溶液变蓝,铜片溶解;装置C中的碱石灰,吸收水蒸气和二氧化碳,正确答案:铜片溶解,溶液变为蓝色;碱石灰。
(3)一氧化氮与过氧化钠反应生成亚硝酸钠,化学方程式为2NO+Na2O2=2NaNO2;正确答案: 2NO+Na2O2=2NaNO2。已知:酸性条件下,NO或NO2-都能与MnO4-反应生成NO3-和Mn2+,E装置的作用是吸收尾气,防止污染;正确答案:2NO+Na2O2=2NaNO2 ;吸收尾气,防止污染。
(4) 根据信息①3NaNO2+3HCl=3NaCl+HNO3+2NO↑+H2O可知,NO与氧气变为NO2,气体变为红棕色,正确操作和现象为:取少量生成物溶于稀硫酸;产生无色气体并在液面上方变为红棕色;正确答案:取少量生成物溶于稀硫酸;产生无色气体并在液面上方变为红棕色。
(5)由关系式为![]() ,可计算出1000g 隔夜熟肉中NaNO2的质量为2.5×0.005×10.10×10-3×69=8.7×10-3g=8.7mg,所以隔夜熟肉中
,可计算出1000g 隔夜熟肉中NaNO2的质量为2.5×0.005×10.10×10-3×69=8.7×10-3g=8.7mg,所以隔夜熟肉中![]() 的含量为8.7 mg/kg;正确答案:8.7。
的含量为8.7 mg/kg;正确答案:8.7。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案科目:高中化学 来源: 题型:
【题目】有关卤族和碱金属元素性质的递变规律说法正确的是
A.卤族元素从F到I,对应氢化物的还原性逐渐增强
B.碱金属元素与O2反应均可得到多种氧化物
C.碱金属元素从Li到Cs,熔沸点逐渐升高
D.X2+2NaI=2NaX+I2(X为:F、Cl、Br)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与 Y同族,Z 与X 形成的离子化合物的水溶液呈中性。下列说法正确的是
A. 简单离子半径:W<X<Z
B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性:W<Y
D. 最高价氧化物的水化物的酸性:Y>Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对分子性质的解释中,不正确的是( )
A. 碘易溶于四氯化碳,甲烷难溶于水都可用相似相溶原理解释
B. 由于乳酸(![]() )中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
)中存在一个手性碳原子,导致该物质存在互为镜像的两个手性异构体
C. HF的稳定性很强,是因为其分子间能形成氢键
D. 由右图可知酸性:H3PO4>HClO,因为H3PO4分子中有1个非羟基氧原子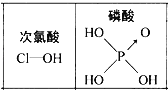
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4℃时,100 mL水中溶解了 22.4 L HCl气体(标准状况下测得)后形成溶液。下列说法正确的是( )
A.该溶液物质的量浓度为10 mol/L
B.该溶液物质的量浓度因溶液的密度未知而无法求得
C.该溶液中溶质的质量分数因溶液的密度未知而无法求得
D.所得溶液的体积为22.5 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】党的十九大报告指出:要持续实施大气污染防治行动,打赢蓝天保卫战。当前空气质量检测的主要项目除了PM2.5外,还有CO、SO2、氮氧化物(NO和NO2)、O3等气体。
(1)汽车尾气中含有NO和CO气体,可利用催化剂对CO、NO进行催化转化反应:
2CO(g)+2NO(g) ![]() N2(g)+2CO2(g) △H
N2(g)+2CO2(g) △H
①已知下列热化学方程式:
N2(g)+O2(g)=2NO(g) △H1=+180.5kJ/mol
2C(s)+O2(g)=2CO(g) △H2=-2210kJ/mol
C(s)+O2(g)=CO2(g) △H3=-393.5kJ/mol
则△H=_________。
②在一定温度下,将2.0molNO、2.4molCO气体通入到固定容积为2L的密闭容器中,反应过程中部分物质的浓度变化如下图所示。在0~15min,以N2表示的该反应的平均速度v(N2)=________。若保持反应体系温度不变,20min时再容器中充入NO、N2各0.4mol,化学平衡将_____移动(填“向左”“向右”或“不”)。

(2)在相同温度下,两个体积均为1L的恒容密闭容器中,发生CO、NO催化转化反应,有关物质的量如下表:
容器编号 | 起始物质的量/mol | 平衡物质的量/mol | |||
NO | CO | N2 | CO2 | CO2 | |
I | 0.2 | 0.2 | 0 | 0 | a |
II | 0.3 | 0.3 | b | 0.1 | 0.2 |
①容器I中平衡后气体的压强为开始时的0.875倍,则a=________。
②容器II平衡时的气体压强为p,用平衡分压代替平衡浓度表示的平衡常数K为________。
(3)汽车使用乙醇汽油并不能破少NOx的排放。某研究小组在实验室以耐高温试剂Ag-ZSW-5对CO、NO催化转化进行研究。测得NO转化为N2的转化率随温度CO混存量的变化情况如图所示。

①在n(NO)/n(CO)=1条件下,最佳温度应控制在_______左右。
②若不使用CO,温度超过775K,发现NO的分解率降低,其可能的原因为________。
③加入CO后NO转化为N2的转化率增大的原因是_______ (用平衡移动的原理解释)。
(4)以NO2、O2、熔融NaNO3组成的燃料电池装置如右图所示,在使用过程中石墨I电极反应生成一种氧化物Y,则该电极反应式为_______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现需配制 0.1mol/LNaOH 溶液 500mL,右图是某同学转移溶液的示意图。
(1)图中的错误是__________________。除了图中给出的的仪器和托盘天平外,还需要的仪器有:_____________.
(2)根据计算得知,所需NaOH的质量为_______________.
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次)____________________________.

A.用 30mL 水洗涤烧杯 2~3 次,洗涤液均注入容量瓶
B.准确称取计算量的氢氧化钠固体于烧杯中,再加入少量水(约 30mL),用玻璃棒慢慢搅动,使其充分溶解
C.将溶解的氢氧化钠溶液沿玻璃棒注入 500mL 的容量瓶中
D.将容量瓶盖紧,反复颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度 1~2cm 处
(4)若出现如下情况,对所配溶液浓度将有何影响(填“偏高”、“偏低”或“无影响”)?
若没有洗涤烧杯 _________________ 若加蒸馏水时不慎超过了刻度线________________________ 若定容时俯视刻度线 ________________________ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给下列烃命名:
(1) ____。
____。
(2) ____。
____。
(3)![]() ____。
____。
(4)有机化合物 的名称为____或____。
的名称为____或____。
(5)2,4二甲基2己烯写出结构简式____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中成药连花清瘟胶囊在对抗 H1N1病毒中发挥重大作用,其有效成分绿原酸的结构简式如图,下列有关说法错误的是
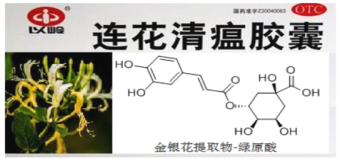
A. 绿原酸属于芳香族化合物
B. 分子中至少有 7 个碳原子共面
C. 1mol 绿原酸最多可消耗 5mol NaOH
D. 与绿原酸苯环上取代基种类及个数均相同的有机物有5 种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com