
| A. | K1=2K2 | B. | K1=K22 | C. | K1=K2 | D. | K1=$\sqrt{{K}_{2}}$ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
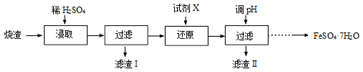
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 淀粉和纤维素水解的最终产物都是葡萄糖 | |
| B. | 油脂在碱的催化作用下可发生水解,工业上利用该反应生产肥皂 | |
| C. | 在加热或重金属盐的情况下,蛋白质都可发生变性 | |
| D. | 液化石油气和天然气的主要成分都是甲烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
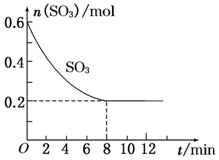 在一个2.0L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:
在一个2.0L的密闭容器中,发生反应2SO3(g)?2SO2(g)+O2(g)△H>0,其中SO3的变化如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 向2mol/L的醋酸溶液中加入镁条,产生气泡的速率先加快再减慢 | 反应刚开始时,醋酸电离平衡正移,c(H+)增大 |
| B | 常温下分别测等浓度的醋酸和氨水pH,发现二者的pH之和为14 | 常温下,醋酸和氨水的电离平衡常数相等 |
| C | 向均盛有2mL5%H2O溶液的两支试管中分别滴入0.2mol/LFe3+,和0.3mol/LCu2+溶液1mL,前者生成气泡的速率更快 | 催化效果:Fe3+>Cu2+ |
| D | 向硼酸(H3BO3)溶液中滴加少量Na2CO3溶液,观察到无明显现象 | H3BO3的酸性弱于H2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作和现象 | 结论 |
| A | 利用Ca(OH)2溶液鉴别Na2CO3和NaHCO3两溶液 | 有沉淀生成的是Na2CO3 |
| B | 室温下,向浓度均为0.1mol•L-1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀. | Ksp(BaSO4)<Ksp(CaSO4) |
| C | 室温下,向FeCl3溶液中滴加少量KI溶液,再滴加几滴淀粉溶液,溶液变蓝色. | Fe3+的氧化性比I2的强 |
| D | 切开金属钠,钠表面的银白色会逐渐褪去 | Na在空气中会生成Na2O2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com