
铁和氧化铁的混合物共a mol,加盐酸后固体全部溶解,共收集到b mol氢气,且向反应后的溶液中加入KSCN溶液不显红色,则原混合物中单质铁的物质的量为 ( )
A.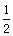 (a+b) mol B.(a-b) mol C.
(a+b) mol B.(a-b) mol C.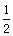 (a-b)mol D.(a+b) mol
(a-b)mol D.(a+b) mol
科目:高中化学 来源: 题型:
下列解 释事实的方程式不正确的是( )
释事实的方程式不正确的是( )
A.测0.1mol/L氨水的pH为11:NH3·H2O NH4++OH-
NH4++OH-
B.将Na块放入水中,产生气体:2Na+2H2O=2NaOH+H2↑
C.用CuCl2溶液做导电实验,灯泡发光:CuCl2 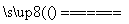 Cu2++2Cl-
Cu2++2Cl-
D.Al片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O=2AlO2-+3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Mg、Al三种金属各2 mol分别跟1L1mol∙L-1的盐酸反应时,相同条件下放出氢气体积最大的是
A.Al B. Mg C. Na D.三者产生的氢气一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氨水,有白色沉淀生成,过滤,在空气中加
热沉淀至质量不再发生变化为止,得到红棕色残渣,上述沉淀和残渣分别是 ( )
A.Fe(OH)3 Fe 2O3 B.Fe(OH)2 Fe2O3
2O3 B.Fe(OH)2 Fe2O3
C.Fe(OH)2 Fe(OH)3 D.Fe(OH)2 Fe3O4
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C为中学常见单质,其中一种为金属,通常情况下,A为固体,B为黄绿色气体,C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体。它们之间的转化关系如下图所示(其中某些反应条件和部分反应物已略去)。
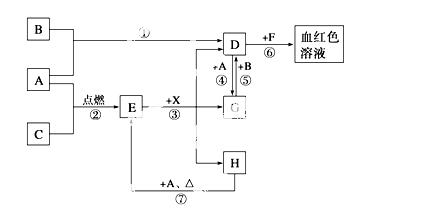
请回答下列问题:
(1)写出下列物质的化学式:A__________、D__________、E__________、X_________。
(2)在反应①~⑦中,不属于氧化还原反应的是__________(填编号)。
(3)反应④的离子方程式是_____________________________________________;
(4)反应⑦的化学方程式是_____________________________________________;
该反应中每消耗0.3 mol的A,可转移电子______mol。
(5)写出D的溶液与小苏打溶液反应的离子方程式是________________________
 _____________________________________________________________________。
_____________________________________________________________________。
(6)除去D溶液中混有的少量G的方法是_________________________________
_____________________________________________________________________。
(7)在D溶液中制备无水D固体的方法是__________________________________
_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组物质中,满足表中图示物质在通常条件下一步转化关系的组合只有
| 序号 | X | Y | Z | W |
|
| ① | Cu | CuSO4 | Cu(OH)2 | CuO | |
| ② | Na | NaOH | Na2CO3 | NaCl | |
| ③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
| ④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A.①②③ B.①③④ C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,反应后固体物质增重的是
A.氢气通过灼热的CuO粉末 B.二氧化碳通过Na2O2粉 末
末
C.铝与Fe2O3发生铝热反应 D.将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
水的电离过程为H2O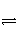
 H++OH-,在不同温度下其平衡常数分别为:K(25℃)=1.0×10-14 mol2·L-2,K(35℃)=2.1×10-14 mol2·L-2,则下列叙述正确的是( )
H++OH-,在不同温度下其平衡常数分别为:K(25℃)=1.0×10-14 mol2·L-2,K(35℃)=2.1×10-14 mol2·L-2,则下列叙述正确的是( )
A.[H+]随着温度的升高而降低
B.在35℃时,[H+]>[OH-]
C.水的电离程度α(25℃)>α(35℃)
D.水的电离是吸热的
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com