
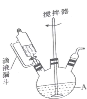
 我国菱镁矿资源丰富、质地优良,是优势矿产之一,其主要成分是碳酸镁.某地菱镁矿中还含有较多的脉石(SiO2)和少量石灰石,利用该菱镁矿制备硫酸镁(MgSO4•7H2O),的实验步骤如下:
我国菱镁矿资源丰富、质地优良,是优势矿产之一,其主要成分是碳酸镁.某地菱镁矿中还含有较多的脉石(SiO2)和少量石灰石,利用该菱镁矿制备硫酸镁(MgSO4•7H2O),的实验步骤如下:分析 (1)根据装置图分析;硫酸与碳酸镁反应很剧烈而且放出大量气体;反应生成的硫酸钙是微溶物质,易包裹在固态表面阻止反应进一步进行;
(2)CaSO4是微溶物质,会形成沉淀;
(3)温度较高时,MgSO4在溶液中溶解度较大;
(4)MgSO4难溶于乙醇,用乙醇洗涤可以减少MgSO4的损失;
(5)晶体受热易分解失去结晶水;
(6)根据消耗的EDTA的量求出镁离子的物质的量,再求出MgSO4•7H2O的质量,根据纯度=$\frac{m(MgS{O}_{4}•7{H}_{2}O)}{m(样品)}$×100%计算.
解答 解:(1)根据装置图可知仪器A为三颈烧瓶;硫酸与碳酸镁反应很剧烈而且放出大量二氧化碳气体,会产生大量的泡沫使物料从反应器中逸出,所以硫酸要分批缓慢加入以降低其反应速率;硫酸与碳酸钙反应生成硫酸钙,硫酸钙是微溶物质,会以沉淀形式析出包裹在镁矿石表面,使镁矿石与硫酸隔离,阻止反应进一步进行;
故答案为:三颈烧瓶;防止硫酸加入过快导致反应中产生大量泡沫使物料从反应器中逸出;防止反应生成的硫酸钙包裹在镁矿石表面导致反应难以进行;
(2)硫酸与碳酸钙反应生成硫酸钙,CaSO4是微溶物质,会形成沉淀,所以沉淀B的主要成分是SiO2和少量CaSO4;
故答案为:CaSO4;
(3)温度较高时,MgSO4在溶液中溶解度较大,所以趁热过滤可以防止MgSO4从溶液中以晶体的形式析出;
故答案为:防止MgSO4•7H2O析出;
(4)MgSO4难溶于乙醇,用乙醇冲洗可以减少MgSO4的损失,而选用冰水、滤液、稀硫酸均能使硫酸镁因为溶解而损失;
故答案为:d;
(5)MgSO4•7H2O受热易分解失去结晶水转化为MgSO4,使得到的硫酸镁晶体的质量减小,所以不能采用直接加热法干燥;
故答案为:加热易使MgSO4•7H2O失去结晶水;
(6)已知EDTA与Mg2+以物质的量1:1反应,滴定时消耗EDTA标准溶液体积的平均值为20.02ml,则EDTA的物质的量为0.0202L×0.05000mol•L-1=1.010×10-3mol,
则n(Mg2+)=1.010×10-3mol,所以n(MgSO4•7H2O)=1.010×10-3mol×$\frac{100}{25}$=4.040×10-3mol,m(MgSO4•7H2O)=4.040×10-3mol×246g/mol=0.9938g,
则MgSO4•7H2O的纯度为:$\frac{m(MgS{O}_{4}•7{H}_{2}O)}{m(样品)}$×100%=$\frac{0.9938g}{1.0000g}$×100%=99.38%;
故答案为:99.38%.
点评 本题考查了物质的制备、分离提纯实验方案的设计,注意把握习题中的信息、物质的性质及混合物分离方法为解答的关键,侧重分析与实验能力、以及计算能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | ①④⑤ | B. | ①②④ | C. | ②③④ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
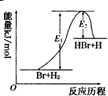
| A. | 该反应的反应热△H=E2-E1 | |
| B. | 加入催化剂,该化学反应的反应热和平衡常数变大 | |
| C. | 正反应的吸热反应 | |
| D. | 升高温度可增大正反应速率,降低逆反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (2)CH2=CH-CH3 (3)CH3COOCH3(4)CH3-CHO (5)CH3-OH (6)CH3CH2COOH
(2)CH2=CH-CH3 (3)CH3COOCH3(4)CH3-CHO (5)CH3-OH (6)CH3CH2COOH| 物质序号 | 物质类别 | 官能团名称 | 物质序号 | 物质类别 | 官能团名称 |
| (1) | (4) | ||||
| (2) | (5) | ||||
| (3) | (6) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
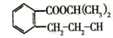 在酸性条件下水解生成M和N:
在酸性条件下水解生成M和N: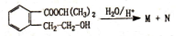
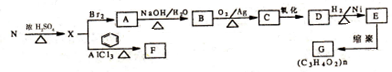
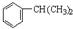 .
.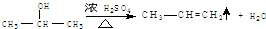 ,E转化为G的化学方程式为
,E转化为G的化学方程式为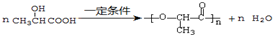 .
.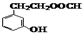 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
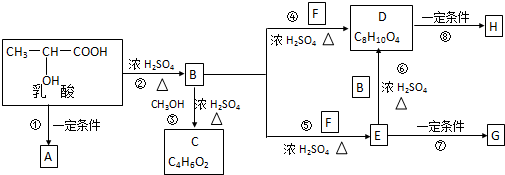
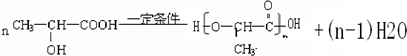 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com