
分析 (1)求出0.012kg12C的物质的量,然后根据1molC中含NA个碳原子来分析;
(2)求出28g氮气的物质的量,然后根据氮气为双原子分子来分析;
(3)CnH2n的最简式为CH2,求出7gCnH2n中含有的CH2的物质的量,从而求得H原子个数;
(4)标况下,水为液态;
(5)ag某气体含分子数为b,则cg该气体中含分子数为$\frac{bc}{a}$个,从而求出物质的量和在标况下的体积;
(6)等温等压下,气体的密度之比等于相对分子质量之比;
(7)氖气所处的状态不明确;
(8)乙烯和丙烯的最简式均为CH2;
(9)求出80gSO3的物质的量,然后根据在三氧化硫分解的过程中,氧原子的个数不变化;
(10)SO2中含2个氧原子.
解答 解:(1)0.012kg12C的物质的量为1mol,而1molC中含NA个碳原子,故正确;
(2)28g氮气的物质的量为1mol,而氮气为双原子分子,故1mol氮气中含2mol原子即2NA个,故正确;
(3)CnH2n的最简式为CH2,7gCnH2n中含有的CH2的物质的量为n=$\frac{7g}{14g/mol}$=0.5mol,故H原子个数为NA个,故正确;
(4)标况下,水为液态,故不能根据气体摩尔体积来计算其物质的量和含有的氧原子的个数,故错误;
(5)ag某气体含分子数为b,则cg该气体中含分子数为$\frac{bc}{a}$个,故气体的物质的量为n=$\frac{bc}{a{N}_{A}}$mol,在标况下的体积为V=$\frac{22.4bc}{a{N}_{A}}$L,故正确;
(6)等温等压下,气体的密度之比等于相对分子质量之比,故3molC2H2(g)和1molC4H6(g)密度相等不相等,故错误;
(7)氖气所处的状态不明确,不一定是标况,故其物质的量和含有的原子个数无法计算,故错误;
(8)乙烯和丙烯的最简式均为CH2,故等质量的两者中含有的CH2的物质的量相等,则含有的碳原子个数相等,故错误;
(9)80gSO3的物质的量为1mol,在三氧化硫分解的过程中,氧原子的个数不变化,故1mol三氧化硫中含有的氧原子个数为3NA个,故正确;
(10)SO2中含2个氧原子,故当SO2的密闭容器中含有NA个氧原子时,SO2的物质的量为0.5mol,故正确.
故答案为:(1)(2)(3)(5)(9)(10).
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用焰色反应鉴别NaCl、KCl | |
| B. | 不用任何试剂可鉴别AlCl3溶液、FeCl3溶液、FeCl2溶液、NaOH溶液CuSO4溶液 | |
| C. | 向某溶液中加入NaOH溶液,加热,用蓝色石蕊试纸检验产生的气体,若试纸变红,则溶液中含有NH${\;}_{4}^{+}$离子 | |
| D. | 品红溶液或高锰酸钾溶液均可鉴别CO2和SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu和AgNO3溶液反应:Cu+Ag+═Cu2++Ag | |
| B. | 往AlCl3溶液中滴入氨水:Al3++3OH-═Al(OH)3↓ | |
| C. | 铁与稀盐酸反应:Fe+2H+═Fe2++H2↑ | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-═BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol/L的CH3COOH溶液中加入少量CH3COONa固体,溶液pH增大 | |
| B. | 在密闭容器中充入一定量NO2建立2NO2(g)?N2O4(g)平衡后,增大压强,体系颜色加深 | |
| C. | 向水中投入金属Na,最终溶液呈碱性 | |
| D. | 在滴有酚酞的Na2CO3溶液中,慢慢滴入BaCl2溶液,溶液的红色逐渐褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C16H25O5 | B. | C14H16O4 | C. | C14H18O5 | D. | C16H25O5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
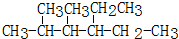
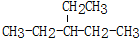 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 项 | ① | ② | ③ | 实验结论 | 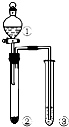 |
| A | 稀盐酸 | Na2SO3 | Na2SiO3溶液 | 非金属性:Cl>C>Si | |
| B | 稀硫酸 | Na2S | 滴加少量AgNO3的KI溶液 | Ksp(AgI)>Ksp(Ag2S) | |
| C | 浓盐酸 | KMnO4 | AgNO3和稀硝酸混合溶液 | Cl2溶于水有Cl-生成 | |
| D | 浓硫酸 | 蔗糖 | Ba(OH)2溶液 | SO2能与碱溶液反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com