
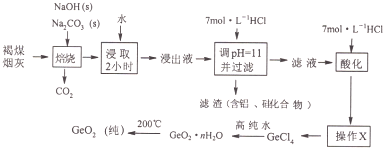
| ||
| ||


科目:高中化学 来源: 题型:
| A、100mL2mol?L-1的盐酸与锌反应时,加入适量的氯化钠溶液,生成氢气的速率不变 |
| B、用铁片和稀硫酸反应制氢气时,改用铁片和浓硫酸反应可增大反应物浓度,所以可以加快产生氢气的速率 |
| C、二氧化硫的催化氧化是一个放热反应,升高温度,反应活化能降低,反应速率加快 |
| D、汽车尾气中的CO和NO可以缓慢反应生成N2和CO2,减小压强,活化分子百分数不变,反应速率减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、与28 g CO具有相同分子数的CO2的质量一定是44 g |
| B、在标准状况下,11.2 L某气体的质量为22 g,则该气体的相对分子质量是44 g/mol |
| C、16 g O2和16 g O3含的氧原子个数一样多 |
| D、1 L 1 mol?L-1Fe(OH)3胶体中胶体微粒数目小于NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验步骤 | 实验现象 |
| ①取少量原溶液,加入稀盐酸, | 产生无色气体,该气体能使澄清的石灰水变浑浊 |
| ②取少量原溶液加热浓缩,加入Cu片和一定浓度的H2SO4 | 有无色气体产生,该气体遇空气变成红棕色 |
| ③取少量原溶液,加入BaCl2溶液 | 有白色沉淀生成 |
| ④取③中上层清液,先加入稀硝酸,再加入AgNO3溶液 | 有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 阴离子 | SO42-、NO3-、Cl- |
| 阳离子 | Fe3+、Fe2+、NH4+、Cu2+、Al3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
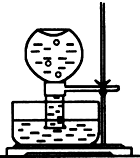 (1)如图所示,现有一瓶饱和氯水倒扣于水槽中,当日光照射到盛有氯水的装置时,可观察到平底烧瓶内有气泡产生,放置一段时间后溶液颜色变浅,产生上述现象的原因是(请用相关的反应方程式和简要文字说明)
(1)如图所示,现有一瓶饱和氯水倒扣于水槽中,当日光照射到盛有氯水的装置时,可观察到平底烧瓶内有气泡产生,放置一段时间后溶液颜色变浅,产生上述现象的原因是(请用相关的反应方程式和简要文字说明)查看答案和解析>>
科目:高中化学 来源: 题型:
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
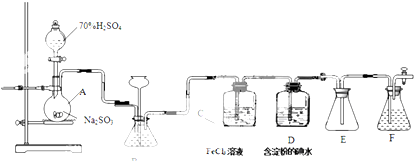
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com