
分析 1mol氯化钠电离产生1mol钠离子,依据m=nM计算氯化纳的质量,结合生理盐水浓度计算解答.
解答 解:需补充0.01mol Na+,则需要氯化钠物质的量为0.01mol,应补充氯化钠质量m=0.01mol×58.5g/mol=0.585g,生理盐水的质量分数是0.9%,生理盐水的密度是1000g/L,溶质氯化钠的摩尔质量是58.5g/mol,通过以上数据得出生理盐水的量浓度是0.9%×1000g/L×58.5g/mol≈0.1538mol/L,则需要生理盐水体积V=$\frac{0.01mol}{0.1538mol/L}$=0.065L,即65mL;
答:NaCl为0.585g;生理盐水为65mL.
点评 本题考查了物质的量有关计算,明确物质的量有关计算公式是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
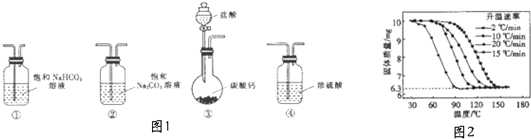
| NaHCO3溶液 BaCl2浓度 | 0.2mol•L-1 | 0.1mol•L-1 | 0.02mol•L-1 |
| 0.2mol•L-1 | 浑浊 | 浑浊 | 少许浑浊 |
| 0.1mol•L-1 | 浑浊 | 少许浑浊 | 无现象 |
| 0.02mol•L-1 | 少许浑浊 | 无现象 | 无现象 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
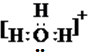 和
和 ;
;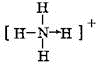 和O=C=O.
和O=C=O.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
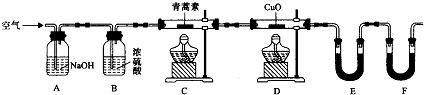
| 装置 | 实验前/g | 试验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤ | B. | ②③④⑥ | C. | ②③④⑤ | D. | ①③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ②③⑤ | C. | ②③④ | D. | ② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量金属钠溶解在AlCl3溶液中:2Na+2H2O=2Na++H2↑ | |
| B. | 铝溶解在NaOH溶液中:2Al+2OH-+2H2O=2AlO2-+3H2↑ | |
| C. | MgO溶于醋酸中:MgO+2H+=H2O+Mg2+ | |
| D. | Al(OH)3溶于稀硫酸中:OH-+H+=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水,有还原性 |
| SiF4 | -90 | -86 | 易水解 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com