
【题目】(1)1.5molH2SO4的质量是__________,其中含有______mol H,含有_______g氧元素。
(2)3.6gH2O的物质的量是 _______ ,含有H2O _______个,含有 _______ g氢元素。
(3)9.03×1023个氨分子含___________摩尔氨分子,____________摩尔氢原子,________________个电子。
(4)已知16gA和20gB恰好完全反应生成0.04molC和31.76gD,则C的摩尔质量为 _______ 。
【答案】147g3960.2mol0.2NA或1.204×10230.41.54.515NA或9.03×1024106g/mol
【解析】
用公式N=n![]() NA、m=n
NA、m=n![]() M、质量守恒定律计算,结合物质的组成进行分析。
M、质量守恒定律计算,结合物质的组成进行分析。
(1)1.5molH2SO4的质量是1.5mol![]() 98g/mol=147g;1个H2SO4分子中含2个H原子、4个O原子,1.5molH2SO4中含有H原子物质的量为1.5mol
98g/mol=147g;1个H2SO4分子中含2个H原子、4个O原子,1.5molH2SO4中含有H原子物质的量为1.5mol![]() 2=3mol;含有O原子物质的量为1.5mol
2=3mol;含有O原子物质的量为1.5mol![]() 4=6mol,含氧元素的质量为6mol
4=6mol,含氧元素的质量为6mol![]() 16g/mol=96g。
16g/mol=96g。
(2)3.6gH2O的物质的量是3.6g![]() 18g/mol=0.2mol;含H2O分子数为0.2NA或0.2mol
18g/mol=0.2mol;含H2O分子数为0.2NA或0.2mol![]() 6.02
6.02![]() 1023mol-1=1.204
1023mol-1=1.204![]() 1023个;1个H2O分子中含2个H原子,含H原子物质的量为0.2mol
1023个;1个H2O分子中含2个H原子,含H原子物质的量为0.2mol![]() 2=0.4mol,含氢元素的质量为0.4mol
2=0.4mol,含氢元素的质量为0.4mol![]() 1g/mol=0.4g。
1g/mol=0.4g。
(3)9.03![]() 1023个NH3分子物质的量为9.03
1023个NH3分子物质的量为9.03![]() 1023
1023![]() (6.02
(6.02![]() 1023mol-1)=1.5mol;1个NH3分子中含3个H原子,含H原子物质的量为1.5mol
1023mol-1)=1.5mol;1个NH3分子中含3个H原子,含H原子物质的量为1.5mol![]() 3=4.5mol;1个NH3分子中含10个电子,含电子物质的量为1.5mol
3=4.5mol;1个NH3分子中含10个电子,含电子物质的量为1.5mol![]() 10=15mol,含电子数为15NA或15mol
10=15mol,含电子数为15NA或15mol![]() 6.02
6.02![]() 1023mol-1=9.03
1023mol-1=9.03![]() 1024个。
1024个。
(4)根据质量守恒定律,m(A)+m(B)=m(C)+m(D),反应生成C的质量m(C)=16g+20g-31.76g=4.24g,C的摩尔质量M(C)=4.24g![]() 0.04mol=106g/mol。
0.04mol=106g/mol。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硝酸工业尾气中的NO、NO2进入大气后,会形成光化学烟雾、破坏臭氧层等。可用氢氧化钠溶液对含氮氧化物的废气进行处理,反应的化学方程式如下:NO2+NO+2NaOH=2NaNO2+H2O;2NO2+2NaOH=NaNO2+NaNO3+H2O。氨气也可以用来处理氮氧化物。例如,氨气与一氧化氮可发生如下反应:4NH3+6NO=5N2+6H2O。将一定量NO和NO2的混合气体通入300mL5mol/LNaOH溶液中,恰好被完全吸收。下列说法不正确的是
A. 若用氨气处理,所需氨气在标准状况下的体积可能为22.4 L
B. 所得溶液中NaNO3和NaNO2的物质的量之比可能为1:2
C. 原混合气体中NO在标准状况下的体积可能为16. 8 L
D. 在用氨气处理氮氧化物时,氮氧化物发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁和高铁酸钾都是常见的水处理剂。某兴趣小组以铁屑为原料模拟工业上制备氯化铁及进一步氧化制备高铁酸钾的流程如下:

请回答下列问题:
(1)“氧化”阶段通入过量空气比用氯气作氧化剂具有的优点是__________________________________。
(2)“合成”阶段生成Na2FeO4的离子方程式为__________________________________。
(3)为了检验“氧化”过程中所得FeCl3溶液中是否含有Fe2+,某同学取少量溶液于试管中,选用下列试剂可以达到目的的是_______(填字母)。
a.KSCN溶液 b.NaOH溶液 c.K3[Fe(CN)6]溶液 d.苯酚溶液
若选用酸性K MnO4溶液进行检验,请分析方案是否合理,并说明理由:_____________________________。
(4)过程①制取FeCl3固体的具体操作步骤是_____________________________________________________。若使6.4mol/LFeCl3饱和溶液不析出Fe(OH)3,需控制溶液的pH小于_______{已知该实验条件下,Ksp[(Fe(OH)3]=8.5×10-36,Kw=1.1×10-13,1.13≈1.33}
(5)在不同温度和不同pH下,FeO42-的稳定性如下图所示:

从上图分析,为了提高“合成”阶段Na2FeO4的产率,可采取的实验条件范围为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯化铁、氯化铜和盐酸的混合溶液中加入铁粉,待反应结束,所剩余的固体滤出后能被磁铁吸引,则反应后溶液存在较多的阳离子是( )
A.Cu2+
B.Fe3+
C.Fe2+
D.H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中能用来区别SO2和CO2气体的是( ) ①澄清的石灰水
②氯水
③酸性高锰酸钾溶液
④氯化钡溶液
⑤品红溶液.
A.①④⑤
B.②③⑤
C.①②③
D.②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.1000mol/L盐酸标准溶液测定某烧碱样品的纯度(杂质不与盐酸反应)。实验步骤如下:
(1)配制待测液:用2.50g含有少量杂质的固体烧碱样品配制500mL溶液液。需用的玻璃仪器除了烧杯、胶头滴管、玻璃棒外,还需要____________________。
(2)滴定:
I.用蒸馏水洗涤酸式滴定管,并立即注入盐酸标准溶液至“0”刻度线以上
II.固定好滴定管并使滴定管尖嘴充满液体,调节液而至“0”或“0”刻度线以下,并记录读数
III.移取20.00mL待测液注入洁净的锥形瓶中,并加入2滴酚酞试液
VI.用标准液滴定至终点,记录滴定管液血读数。
①上述滴定步骤中有错误的是(填编号)_________,该错误操作会导致测定结果___(填“偏大”、“偏小”或“无影响”)。
②步骤IV中滴定时眼睛应________;判断滴定终点的现象是________。
③若步骤II中仰视读数,步骤IV中俯视读数,则会使测定结果____(填“偏大”、“偏小”或“无影响”)。
(3)按正确操作测得有关数据记录如下:
滴定次数 | 待测液体积 | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 20.00 | 0.20 | 20.38 |
第二次 | 20.00 | 4.00 | 24.20 |
第三次 | 20.00 | 2.38 | a |
①a的读数如图所示,则a=______;②烧碱样品的纯度为________%。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钠、氯及其化合物有如下转化关系,请按要求填空:

(1)Na、Na2O、Na2O2、NaOH久置空气中最终都是变为____________(填化学式);
(2)Na放在石棉网上加热反应的化学方程式为______________________________
(3)Na2O2与水反应的化学方程式为__________________________________
(4)一小块金属钠投入CuCl2溶液中,发生反应的方程式有:___________,和_________________________________________________________________.
(5)在点燃的条件下Fe 与Cl2发生反应的现象为_____________________________________________,反应的化学方程式为______________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
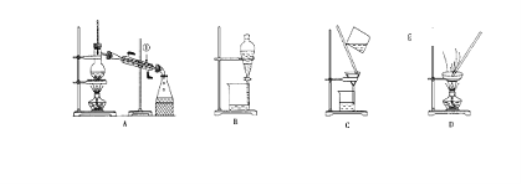
(1)从氯化钾溶液中得到氯化钾固体,选择装置____________(填代表装置图的字母,下同);除去自来水中的Cl-等杂质,选择装置____________。
(2)从碘水中分离出I2,选择装置_________,该分离方法的名称为___________。
(3)装置A中①的水的进出方向是_________,A中所有玻璃仪器的名称分别是__________。
Ⅱ.对于混合物的分离或提纯,常采用的方法有:A、分液 B、过滤 C、萃取 D、蒸馏 E、结晶 F、加热分解,下列各组物质的分离或提纯,应选用上述方法的哪一种?(填字母序号)
(4)除去Ca(OH)2溶液中悬浮的CaCO3__________;
(5)分离植物油和水__________;
(6)除去NaCl中所含的少量KNO3___________;
(7)除去CaO中少量CaCO3__________;
(8)用食用酒精浸泡中草药提取其中的有效成份_________;
(9)回收碘的CCl4溶液中的CCl4__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,红褐色液体或黄色气体,具有刺鼻恶臭味,遇水反应生成一种氢化物和两种氧化物。某学习小组在实验室用Cl2和NO制备ClNO并测定其纯度,相关实验(夹持装置略去) 如下。请回答:

(1)制备Cl2发生装置可以_____(填大写字母),反应的离子方程式为____________________。
(2)欲收集一瓶干燥的氯气,选择装置,其连接顺序为:a![]() ______________________(按气流方向,用小写字母表示),若用到F,其盛装药品为____________________。
______________________(按气流方向,用小写字母表示),若用到F,其盛装药品为____________________。
(3)实验室可用下图装置制备亚硝酰氯(ClNO);

①实验室也可用B装置制备NO,X装置的优点为________________________________。
②检验装置气密性并装入药品,打开k2,然后再打开________(填“k1”"或“k3”),通入一段时间气体,(其目的为_________________________________________________),然后进行其它操作,当Z有一定量液体生成时,停止实验。
③若无装置Y,则Z中ClNO可能发生反应的化学方程式为__________________。
(4)取Z中所得液体m g溶于水,配制成250mL溶液,取出25.00mL,以K2CrO4溶液为指示剂,用c mol·L-1AgNO3标准溶液滴定至终点,消耗标准溶液的体积为22.50mL。(已知:Ag2CrO4为砖红色固体;
Ksp(AgCl)=1.56×10-10,Ksp(Ag2CrO4)=1×10-12),则亚硝酰氯(ClNO)的质量分数为_______________(用代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com