
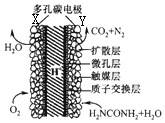
 直接尿素电池的结构如图所示,下列说法不正确的是( )
直接尿素电池的结构如图所示,下列说法不正确的是( )| A. | 电池工作时,化学能转化为电能 | |
| B. | 电池工作时,H+向Y极区迁移,Y极周围溶液的pH减小 | |
| C. | 碳电池采用多孔并用触媒层可加快反应速率 | |
| D. | Y极的电极反应式为H2NCONH2+H2O-6e-═N2↑+CO2+6H+ |
分析 图示原电池中X电极为正极,Y为负极,
A.原电池是化学能转化为电能;
B.电池工作时阳离子移向正极;
C.碳电池采用多孔并用触媒层起到加快反应速率的作用;
D.Y极的电极反应是尿素失电子生成二氧化碳和氮气.
解答 解:A.图示为原电池,电池工作时,化学能转化为电能,故A正确;
B.电池工作时阳离子移向正极,H+向X极区迁移,Y极附近生成氢离子周围溶液的pH减小,故B错误;
C.多孔并用触媒层可以加快反应速率,故C正确;
D.Y极的电极反应是酸性电解质溶液中,尿素失电子生成二氧化碳和氮气Y极的电极反应式为:H2NCONH2+H2O-6e-═N2↑+CO2+6H+,故D正确;
故选B.
点评 本题考查了原电池原理、待测电极判断、电极反应书写等知识点,掌握基础是解题关键,题目难度中等.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m=2 | |
| B. | 两次平衡的平衡常数相同 | |
| C. | X与Y平衡转化率之比为1:1 | |
| D. | 第二次平衡时,Z的浓度为0.4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 25℃~550℃~600℃~700℃ |
| 主要成分 | WO3 W2O5 WO2 W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:W>Z | |
| B. | X和W形成的化合物属于离子化合物 | |
| C. | 由X、Y、Z三种元素组成化合物的水溶液一定显酸性 | |
| D. | Z最简单氢化物分子间存在氢键,故其稳定性强于Y最简单氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
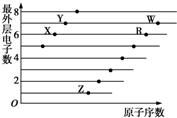 如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )
如图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图.下列说法正确的是( )| A. | X与W形成的化合物中只有共价键 | B. | X与Z形成的化合物中只有离子键 | ||
| C. | 元素的非金属性:X>R>W | D. | 简单离子的半径:W>R>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 海水提溴时用到热空气将Br2吹出 | B. | 工业制HCl时氯气在氢气中燃烧 | ||
| C. | 硫酸工业中使用到热交换器 | D. | 石油通过分馏得到裂化汽油 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com