
| A. | 用米汤检验食用加碘盐(含KIO3)中含有碘 | |
| B. | 用醋、澄清石灰水验证蛋壳中含有碳酸盐 | |
| C. | 用碘酒检验汽油中是否含有不饱和烃 | |
| D. | 用鸡蛋白、食盐、水完成蛋白质的溶解、盐析实验 |
分析 A.淀粉遇碘单质变蓝;
B.碳酸盐与醋酸反应生成二氧化碳气体,二氧化碳可使澄清石灰水变浑浊;
C.不饱和烃与碘发生加成反应;
D.食盐可使蛋白质发生盐析,为可逆过程.
解答 解:A.淀粉遇碘单质变蓝,则米汤不能检验食用加碘盐(含KIO3)中含有碘,故A错误;
B.碳酸盐与醋酸反应生成二氧化碳气体,二氧化碳可使澄清石灰水变浑浊,则醋、澄清石灰水可验证蛋壳中含有碳酸盐,故B正确;
C.不饱和烃与碘发生加成反应,则用碘酒可检验汽油中是否含有不饱和烃,故C正确;
D.食盐可使蛋白质发生盐析,为可逆过程,则用鸡蛋白、食盐、水可完成蛋白质的溶解、盐析实验,故D正确;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠的电子式: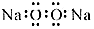 | B. | 次氯酸钠的结构式:H-Cl-OC | ||
| C. | 氯化铵的电子式: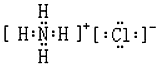 | D. | 硫离子的结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| t/℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质类别 | 烯烃 | 酚 | 醛 | 硝基化合物 |
| 官能团名称 | 碳碳双键 | 羟基 | 醛基 | 硝基 |
| 结构简式 |  | -OH | -CHO | -NO2 |
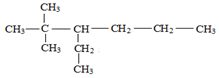 的名称为2,2-二甲基-3-乙基己烷.
的名称为2,2-二甲基-3-乙基己烷.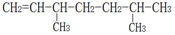 的名称为2,5-二甲基-1-庚烯.
的名称为2,5-二甲基-1-庚烯.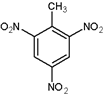 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Fe3+)=0.1 mol/L溶液中:Na+、NH4+、SCN-、SO42- | |
| B. | 能溶解CaCO3的溶液中:Fe3+、Ca2+、Cl-、NO3- | |
| C. | 由水电离出的c(H+)=1×10-2mol/L的溶液中:Na+、Ba2+、HCO3-、Cl- | |
| D. | 强碱性溶液中:K+、Na+、ClO-、I- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 阅读分析下列材料:
阅读分析下列材料:| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| 乙二醇 C2H6O2 | -11.5 | 198 | 1.11 | 易溶于水和乙醇及其他有机溶剂 |
| 丙三醇 C3H8O3 | 17.9 | 290 | 1.26 | 能跟水和酒精以任意比互溶;易溶于其他有机溶剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com