
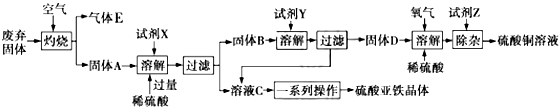
分析 工业废弃固体(主要成分为Cu2S和FeS2)灼烧得氧化铜和氧化铁及二氧化硫气体,所以E为SO2,固体A为氧化铜和氧化铁的混合物,A中加入硫酸溶解,再加入过量的铁粉,得硫酸亚溶液和铜固体,过滤后得到溶液C为FeSO4溶液,固体B为铁、铜混合物,B中加入稀硫酸得硫酸亚铁溶液和铜固体,所以固体D为Cu,硫酸亚铁溶液蒸发浓缩、降温结晶可得绿矾晶体,铜与稀硫酸溶液中通入氧气除杂后得硫酸铜溶液.
(1)FeS2在空气中灼烧生成氧化铁与二氧化硫;
(2)试剂X为Fe,试剂Y为硫酸;
(3)从溶液中获得晶体,需要经过蒸发浓缩、冷却结晶、过滤、洗涤等操作;
(4)酸性条件下,氧气将亚铁离子氧化为铁离子,铁离子与Cu反应生成铜离子与亚铁离子,整个过程中亚铁离子起催化剂作用;
(5)除杂时需加入双氧水将Fe2+氧化为Fe3+,再加试剂Z调节溶液pH以除去Fe3+,加入试剂Y要不引入新杂质且可以与氢离子反应;
根据Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=1.0×10-38计算c(OH-),再根据水的离子积计算c(H+),溶液pH=-lgc(H+).
解答 解:工业废弃固体(主要成分为Cu2S和FeS2)灼烧得氧化铜和氧化铁及二氧化硫气体,所以E为SO2,固体A为氧化铜和氧化铁的混合物,A中加入硫酸溶解,再加入过量的铁粉,得硫酸亚溶液和铜固体,过滤后得到溶液C为FeSO4溶液,固体B为铁、铜混合物,B中加入稀硫酸得硫酸亚铁溶液和铜固体,所以固体D为Cu,硫酸亚铁溶液蒸发浓缩、降温结晶可得绿矾晶体,铜与稀硫酸溶液中通入氧气除杂后得硫酸铜溶液.
(1)FeS2在空气中灼烧生成氧化铁与二氧化硫,反应方程式为:4FeS2+11O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3+8SO2,
故答案为:4FeS2+11O2$\frac{\underline{\;点燃\;}}{\;}$2Fe2O3+8SO2;
(2)由上述分析可知,试剂X为过量铁粉,试剂Y为过量硫酸,
故答案为:过量铁粉;过量硫酸;
(3)溶液C通过蒸发浓缩、冷却结晶、过滤等操作得到硫酸亚铁晶体,
故答案为:蒸发浓缩、冷却结晶;
(4)酸性条件下,氧气将亚铁离子氧化为铁离子,铁离子与Cu反应生成铜离子与亚铁离子,整个过程中亚铁离子起催化剂作用,则催化过程中反应的离子方程式为:4Fe2++O2+4H+=4Fe3++2H2O、Cu+2Fe3+=2Fe2++Cu2+,
故答案为:4Fe2++O2+4H+=4Fe3++2H2O、Cu+2Fe3+=2Fe2++Cu2+;
(5)除杂时需加入双氧水将Fe2+氧化为Fe3+,再加试剂Z调节溶液pH以除去Fe3+,加入试剂Y要不引入新杂质且可以与氢离子反应,试剂Y为CuO、Cu(OH)2、CuCO3等,
铁元素的离子浓度小于10-5mol/L时沉淀完全,由Ksp[Fe(OH)3]=c(Fe3+)×c3(OH-)=1.0×10-38,可得c(OH-)=1.0×10-11mol/L,则c(H+)=$\frac{1{0}^{-14}}{1{0}^{-11}}$mol/L=1.0×10-3mol/L,溶液pH=-lg1.0×10-3=3,
故答案为:CuO等;3.
点评 本题考查物质制备工艺流程,涉及对操作与试剂的分析评价、物质分离提纯、条件控制等,侧重于学生的分析能力和实验能力的考查,关键是理解实验原理和操作流程,熟练掌握元素化合物性质,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
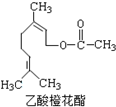 某食用香料乙酸橙花酯的结构简式如图所示,关于该有机物的下列叙述中正确的是( )
某食用香料乙酸橙花酯的结构简式如图所示,关于该有机物的下列叙述中正确的是( )| A. | ①②③ | B. | ①②④ | C. | ①②⑤ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钠的水解反应:CO32-+H2O?HCO3-+OH- | |
| B. | 粗铜精炼时,与电源正极相连的是粗铜,电极反应式为:Cu-2e-═Cu2+ | |
| C. | 钢铁发生电化学腐蚀的负极反应式:Fe-2e-═Fe2+ | |
| D. | 碱性氢氧燃料电池负极反应式:O2+2H2O+4e-═4OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
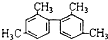 的烃,下列说法正确的是( )
的烃,下列说法正确的是( )| A. | 分子中至少有9个碳原子处于同一平面上 | |
| B. | 分子中至少有11个碳原子处于同一平面上 | |
| C. | 该有机物不能使酸性KMnO4溶液褪色 | |
| D. | 该烃属于苯的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氮可形成多种气态氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是
氮可形成多种气态氧化物,如NO、NO2、N2O4等.已知NO2和N2O4的结构式分别是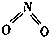 和
和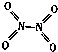 .实验测得N-N键的键能为167kJ•mol-1,NO2中氮氧键的键能为 466kJ•mol-1,N2O4中氮氧键的键能为438.5kJ•mol-1.
.实验测得N-N键的键能为167kJ•mol-1,NO2中氮氧键的键能为 466kJ•mol-1,N2O4中氮氧键的键能为438.5kJ•mol-1.| 时间/s | 0 | 20 | 40 | 60 | 80 |
| n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
| n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 酸性:H2SiO3<H2CO3 | B. | 碱性:Mg(OH)2>Al(OH)3 | ||
| C. | 稳定性:SiH4>PH3 | D. | 原子半径:N<C |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com