

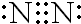 ,故答案为:
,故答案为: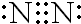 ;
;| 2 |
| 3 |
| 2 |
| 3 |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A、常温常压下,1mol乙烯共用电子对数为4NA | ||
| B、1molD318O+中含有的中子数为10NA | ||
C、标准状况下,1L戊烷充分燃烧后生成气态产物的分子数为
| ||
| D、0.1mol乙烯和乙醇的混合物完全燃烧所消耗的氧原子数一定为0.6 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| a |
| b |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在标准状况下,2.24L二氯甲烷中所含分子数大于0.1NA |
| B、常温下,0.1mol甲烷与甲醛混合气体中所含碳原子数为0.1NA |
| C、0.1mol硅酸钠溶于水所得溶液中所含阴离子数等于0.1NA |
| D、1LpH=1的醋酸溶液中,CH3COO-和OH-数目之和为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Cu(OH)2 |
| 开始沉淀 | 1.1 | 4.0 | 5.4 |
| 完全沉淀 | 3.2 | 5.2 | 6.7 |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 下列两组实验中的a、b、c都是必修教材中的常见物质,它们都有如图所示的转化关系(图中的箭头“→”表示在一定条件下,物质的转化可以一步完成),试完成下列表格.
下列两组实验中的a、b、c都是必修教材中的常见物质,它们都有如图所示的转化关系(图中的箭头“→”表示在一定条件下,物质的转化可以一步完成),试完成下列表格.
| 序号 | 已知情境 | 化学式 | 对应的离子反应方程式和现象 |
| (1) | 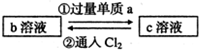 已知b溶液中滴入KSCN溶液后,溶液呈红色. |
a |
反应①的离子方程式 反应②的离子方程式 |
| (2) |  已知b为一种常见的氧化性强酸,其中某非金属元素的最高价为+5. 已知b为一种常见的氧化性强酸,其中某非金属元素的最高价为+5. |
c |
反应③的现象为 |
查看答案和解析>>
科目:高中化学 来源: 题型:
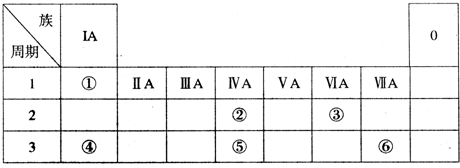

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.1L 1mol/L的AlCl3溶液中Al3+数是0.1NA |
| B、标准状况下,2.24L甲烷分子的电子数是NA |
| C、25℃时,pH=13的1.0L的Ba(OH)2溶液中含有的OH-数是0.2 NA |
| D、0.1L 1mol/L的醋酸溶液中的分子数是0.1NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com