
【题目】煤和石油不仅是重要的矿物能源,更可以通过综合利用得到多种有机化工产品。
煤干馏后可得到焦炭、煤焦油、粗氨水和焦炉气等。焦炭可通过以下途径制取聚氯乙烯等化工产品。

完成下列填空:
(1)氯乙烯转化为聚氯乙烯的化学方程式____________________。
(2)HC≡C-CH=CH2与正四面体烷![]() 的关系是____(选填“同系物”“同分异构体”)。若分别完全燃烧等质量的HC≡C-CH=CH2和乙炔,所需氧气的量__________ (选填“前者多”“后者多”“一样多”)。
的关系是____(选填“同系物”“同分异构体”)。若分别完全燃烧等质量的HC≡C-CH=CH2和乙炔,所需氧气的量__________ (选填“前者多”“后者多”“一样多”)。
(3)检验C2H4O中是否含有醛基的实验方法是_________________。
乙烯是石油化工最重要的基础原料,下图是工业合成物质C的流程:
![]()
完成下列填空:
(4)A与浓硫酸在共热条件下制取乙烯的反应类型是_________。
(5)B的分子式为C2H4O2,与纯碱反应能生成二氧化碳气体,写出A+B→C的化学方程式____________________。
(6)乙烯可用来合成聚乙二酸乙二酯![]() 。以乙烯为原料,无机试剂任选,设计聚乙二酸乙二酯的合成路线。
。以乙烯为原料,无机试剂任选,设计聚乙二酸乙二酯的合成路线。
(合成路线常用的表示方式为:![]() )
)
_____________________。
【答案】 nCH2=CHCl ![]()
![]() CH2-CHCl
CH2-CHCl![]() 同分异构体 一样多 取样于试管,加入适量水溶解,加入新制Cu(OH)2悬浊液,并加热 若出现砖红色沉淀,证明分子中含醛基,反之不含醛基 消去 CH3COOH + CH3CH2OH
同分异构体 一样多 取样于试管,加入适量水溶解,加入新制Cu(OH)2悬浊液,并加热 若出现砖红色沉淀,证明分子中含醛基,反之不含醛基 消去 CH3COOH + CH3CH2OH ![]() CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O 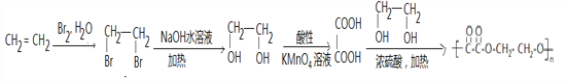
【解析】(1)氯乙烯发生加聚反应生成聚氯乙烯,反应的化学方程式为nCH2=CHCl ![]()
![]() CH2-CHCl
CH2-CHCl![]() ,故答案为:nCH2=CHCl
,故答案为:nCH2=CHCl ![]()
![]() CH2-CHCl
CH2-CHCl![]() ;
;
(2)HC≡C-CH=CH2与正四面体烷的分子式相同,均为C4H4,但结构不同,属于同分异构体;HC≡C-CH=CH2和乙炔的最简式相同,均为CH,若分别完全燃烧等质量的HC≡C-CH=CH2和乙炔,所需氧气的量相同,故答案为:同分异构体;一样多;
(3) 醛能够发生银镜反应和与新制的氢氧化铜悬浊液反应,因此检验C2H4O中是否含有醛基的实验方法是取样于试管,加入适量水溶解,加入新制Cu(OH)2悬浊液,并加热 若出现砖红色沉淀,证明分子中含醛基,反之不含醛基,故答案为:取样于试管,加入适量水溶解,加入新制Cu(OH)2悬浊液,并加热 若出现砖红色沉淀,证明分子中含醛基,反之不含醛基;
(4)乙烯在催化剂作用下遇水加成反应生成乙醇,A为乙醇,乙醇与浓硫酸在共热条件下发生消去反应生成乙烯,故答案为:消去反应;
(5)B的分子式为C2H4O2,为乙醇发生催化氧化生成的乙酸,乙酸与纯碱反应能生成二氧化碳气体,则乙醇与乙酸发生酯化反应生成乙酸乙酯,反应的化学方程式为CH3COOH + CH3CH2OH ![]() CH3COOCH2CH3 + H2O,故答案为:CH3COOH + CH3CH2OH
CH3COOCH2CH3 + H2O,故答案为:CH3COOH + CH3CH2OH ![]() CH3COOCH2CH3 + H2O;
CH3COOCH2CH3 + H2O;
(6)以乙烯合成聚乙二酸乙二酯![]() 。首先需要合成乙二醇和乙二酸,乙烯与溴加成可以上传1,2-二溴乙烷,水解后生成乙二醇,乙二醇氧化可以生成乙二酸,合成路线为
。首先需要合成乙二醇和乙二酸,乙烯与溴加成可以上传1,2-二溴乙烷,水解后生成乙二醇,乙二醇氧化可以生成乙二酸,合成路线为 ,故答案为:
,故答案为: 。
。


 优学名师名题系列答案
优学名师名题系列答案科目:高中化学 来源: 题型:
【题目】中药药剂砒霜(主要成分As2O3,微溶于水)在医疗上用于治疗急性白血病。某课题组以一种含砷精矿石粉(主要成份为As4S4、As2S3、FeS2及其它惰性杂质)为原料制取As2O3, 工艺流程简图如下:

回答下列问题:
(1)过程I中所得SO2气体可回收再利用,下列有关SO2用途的说法正确的是______。
A.工业制硫酸 B.漂白纸张 C.自来水消毒
(2)过程II中发生的反应______氧化还原反应(填“是”或“不是”)。
(3)过程V中系列操作为_______ (填化学实验基本操作名称)。
(4)①过程I中焙烧As2S3的化学反应方程式为_______________。
②过程IV中生成As2O3的离子反应方程式为_______________。
(5)有毒的AsO33-通过电解反应可转化为无毒的AsO43-。用石墨为电极,在强碱性溶液中电解含AsO33-的溶液,阳极的电极反应式为______________。
(6)测定某As2O3粗产品(含As2O5杂质)中As2O3的质量分数的实验过程如下:
a.称取m g粗产品溶解于NaOH溶液,得到含AsO33-、AsO43-的混合溶液l00mL。
b.分别移取25.00mL上述溶液,用0.02500 mol·L-1的I2标准溶液进行滴定(I2将AsO33-氧化为AsO43-,淀粉溶液为指示剂)。每次滴定开始时液面读数如图一所示,三次滴定结束时,I2标准溶液液面读数如图二图四所示。

①描述滴定终点的现象_____________________。
②粗产品中As2O3的质量分数为______________ (用含有m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组探究少量Cl2和FeBr2反应的过程。
(1)配制FeBr2溶液:
ⅰ.配制50mL1.0mol/LFeBr2溶液;
ⅱ.上述溶液呈淡黄色。取少量此溶液,向其中滴入KSCN溶液,变为浅红色。
①配制50mL1.0mol/LFeBr2溶液需要的玻璃容器是________________。
②由ⅱ可知,此FeBr2溶液呈黄色的原因是其中含有________,用离子方程式解释产生其原因:_______。
(2)氯气和FeBr2反应实验操作及现象如下:

据此甲同学得出结论:少量Cl2既能和Fe2+又能和Br-发生氧化还原反应。
①Cl2和Fe2+发生反应的离子方程式是________________。
②乙同学认为上述实验不能证明Cl2和Br-发生反应,理由是_____________。
③乙同学改进实验如下:在上述FeBr2溶液中加入过量铁粉,取上清液2 mL,向其中滴加3滴饱和氯水后,再加入CCl4,振荡后静置,观察现象。乙得出结论:少量Cl2只与Fe2+反应,不与Br-反应。乙得出该结论依据的实验现象是____________________。
(3)丙同学继续设计实验,探究反应过程:

①转移到大试管前CCl4液体中呈红棕色的物质是___________。
②丙通过此实验可得出结论:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在一个2L的密闭容器中,X、Y、Z三气体种物质的物质的量随时间的变化曲线如图所示,据此回答:

(1)该反应的化学方程式为___________
(2)从开始至2min,X的平均反应速率为________mol/(L·min)
(3)改变下列条件,可以加快化学反应速率的有_________
A.升高温度 B.减小物质X的物质的量 C.增加物质Z的物质的量. D.减小压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的工业制法中,不正确的是:
A. 制钠:用海水为原料制得精盐,再电解纯净的NaCl溶液
B. 制镁:用海水为原料,经一系列过程制得氯化镁固体,电解熔融的氯化镁得镁
C. 制铁:以铁矿石为原料,CO还原得铁
D. 制漂白粉:将氯气通入石灰乳中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组中的离子,能在溶液中大量共存的是
A. K+、Mg2+、NO3-、Cl- B. Ba2+、Na+、CO32-、 OH-
C. Mg2+、Ba2+、OH-、NO3- D. H+、 K+、 CO32-、 SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某制糖厂以甘蔗为原料制糖,同时得到大量的甘蔗渣,对甘蔗渣进行综合利用。不仅可以提高经济效益,而且还能防止环境污染,生产流程如下:

已知石油裂解已成为生产C的主要方法,E的溶液能发生银镜反应,G是具有果香味的液体,试填空:
(1) B的名称:_________________;D中官能团的名称:___________________。
(2) 写出C发生加聚反应的方程式:___________________。
(3) D→E的化学方程式:_____________________;F→G的化学方程式:_____________________。
(4)已知HCOOCH3也具有果香味,则该物质与G的关系互称为_________________,与F的关系互称为:_________________。
下图为实验室制取G的装置图,图中a试剂名称为________________,实验结束后分离a和G的方法为_________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是元素周期表的一部分,①~⑨是元素周期表中的部分元素。
ⅠA | 0 | |||||||
ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |||
…… | ② | ③ | ④ | |||||
⑤ | ⑥ | …… | ⑦ | ⑧ | ⑨ | |||
请回答下列问题:
(1)⑥的元素符号是_______ ,⑦的原子结构示意图 _______________________,原子半径⑤______⑥(填“>”或“<”)。
(2)元素②③④的气态氢化物中最稳定的是______________(填化学式)。
(3)元素⑤的最高价氧化物对应的水化物与元素⑨的氢化物的水溶液发生反应的离子方程式是_________________________________。
(4)元素①和⑨形成的化合物的电子式是_____________________。
(5)元素非金属性⑧_______⑨(填“>”或“<”)。
(6)已知元素⑧的原子序数为a,则元素③的原子序数可能为___________。
A、a + 8 B、a-8 C、a + 2 D、a-2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com