
【题目】某研究性学习小组通过下列反应原理制备SO2并进行性质探究.反应原理为:Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2↑+H2O 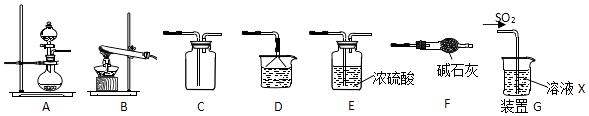
(1)根据上述原理制备并收集干燥SO2的实验装置连接顺序为 .
(2)D中盛装的试剂为 .
(3)甲同学用注射器吸取纯净的SO2并结合装置G进行SO2的性质实验,若X是Na2S溶液,其目的是检验SO2的 , 可观察到的现象 .
(4)实验1:乙同学将溶液X换为浓度均为0.1mol/L Fe(NO3)3和BaCl2的混合溶液(已经除去溶解氧),通入少量SO2后观察到烧杯产生白色沉淀,乙同学认为白色沉淀为BaSO4 , 为探究白色沉淀的成因,他继续进行如下实验验证:(已知:0.1mol/L Fe(NO3) 3的pH=2)
实验 | 操作 | 现象 | 结论和解释 |
2 | 将SO2通入0.1mol/L和BaCl2混合液 | 产生白色沉淀 | Fe3+能氧化H2SO3 |
3 | 将SO2通入和 BaCl2混合液 | 产生白色沉淀 | 酸性条件NO3﹣能将H2SO3氧化为SO42﹣ |
(5)丙同学认为以上实验只能说明Fe3+和酸性条件下NO3﹣均能将H2SO3氧化为SO42﹣ , 不能说明谁先氧化H2SO3 , 他利用提供的试剂(限选试剂:KSCN溶液,K3[Fe(CN)6]溶液,苯酚溶液,硝酸溶液)设计实验方案探究何种微粒先发生反应.请帮助他完成方案(包括操作现象和结论):取乙同学实验1后装置G中烧杯的上层清液于试管中, .
(6)丁同学在实验2过程发现,黄色溶液先变红棕色后慢慢变浅绿色,查阅资料得:Fe3++6SO2Fe(SO2)63+(红棕色).请用化学平衡移动原理解释实验2中溶液颜色变化的原因 .
【答案】
(1)AECED或AECD或AECF
(2)NaOH溶液
(3)氧化性;产生黄色沉淀
(4)FeCl3;0.01mol/LHNO3
(5)往试管中滴加铁氰化钾溶液,若溶液出现蓝色沉淀,则证明是Fe3+先氧化H2SO3 , 若溶液没有明显现象,则证明是pH=2的HNO3先氧化H2SO3
(6)反应2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+(反应①)较Fe3++6SO2?Fe(SO2)63+(反应②)反应缓慢,故先发生反应②,然后发生反应①,但反应①的限度较大,故溶液中c(Fe3+)慢慢降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液
【解析】解:(1)反应原理为:Na2SO3(固)+H2SO4(浓)=Na2SO4+SO2↑+H2O,根据上述原理制备并收集干燥SO2的实验装置选择A为发生装置,生成二氧化硫中含水蒸气,通过装置E中的浓硫酸干燥二氧化硫气体,通过装置C收集二氧化硫气体,剩余气体不能排放需要通过装置D或F吸收,制备并收集干燥SO2的实验装置连接顺序为:AECED 或AECD或AECF,所以答案是:AECED 或AECD或AECF;(2)D装置是吸收多余的二氧化硫气体,D中盛装的试剂为氢氧化钠溶液,
所以答案是:NaOH溶液;(3)甲同学用注射器吸取纯净的SO2并结合装置G进行SO2的性质实验,若X是Na2S溶液,则二氧化硫和硫化钠发生氧化还原反应生成硫单质,反应的化学方程式为:2Na2S+SO2+2H2O=3S+4NaOH,表现了二氧化硫的氧化性,反应现象为生成黄色沉淀,
所以答案是:氧化性;产生黄色沉淀;(4)乙同学将溶液X换为浓度均为0.1mol/L Fe(NO3)3和BaCl2的混合溶液(已经除去溶解氧),通入少量SO2后观察到烧杯产生白色沉淀,乙同学认为白色沉淀为BaSO4 , 铁离子氧化二氧化硫生成硫酸,结合钡离子生成硫酸钡沉淀,二氧化硫通入硝酸的氯化钡溶液中,稀硝酸氧化二氧化硫为硫酸生成硫酸钡沉淀;
将SO2通入0.1mol/L FeCl3和BaCl2混合液产生白色沉淀,是Fe3+能氧化H2SO3 , 将SO2通入0.01mol/L HNO3 和 BaCl2混合液,产生白色沉淀酸性条件NO3﹣能将H2SO3氧化为SO42﹣ ,
所以答案是:FeCl3;0.01mol/L HNO3;(5)丙同学认为以上实验只能说明Fe3+和酸性条件下NO3﹣均能将H2SO3氧化为SO42﹣ , 不能说明谁先氧化H2SO3 , 他利用提供的试剂(限选试剂:KSCN溶液,K3[Fe(CN)6]溶液,苯酚溶液,硝酸溶液)设计实验方案探究何种微粒先发生反应,取乙同学实验1后装置G中烧杯的上层清液于试管中,往试管中滴加铁氰化钾溶液,若溶液出现蓝色沉淀,则证明是Fe3+先氧化H2SO3 , 若溶液没有明显现象,则证明是pH=2的HNO3先氧化H2SO3 ,
所以答案是:往试管中滴加铁氰化钾溶液,若溶液出现蓝色沉淀,则证明是Fe3+先氧化H2SO3 , 若溶液没有明显现象,则证明是pH=2的HNO3先氧化H2SO3;(6)丁同学在实验2过程发现,黄色溶液先变红棕色后慢慢变浅绿色,查阅资料得:Fe3++6SO2Fe(SO2)63+(红棕色).请用化学平衡移动原理解释实验2中溶液颜色变化的原因是:反应2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+(反应①)较Fe3++6SO2Fe(SO2)63+(反应②)反应缓慢,故先发生反应②,然后发生反应①,但反应①的限度较大,故溶液中c(Fe3+)慢慢降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液,所以答案是:反应2Fe3++SO2+2H2O=2Fe2++SO42﹣+4H+(反应①)较Fe3++6SO2Fe(SO2)63+(反应②)反应缓慢,故先发生反应②,然后发生反应①,但反应①的限度较大,故溶液中c(Fe3+)慢慢降低,平衡逆向移动,红棕色逐渐褪去,最终得到浅绿色溶液.


科目:高中化学 来源: 题型:
【题目】现有含NaCl、MgCl2和CaCl2的混合溶液,某兴趣小组的同学欲提取纯净的NaCl晶体,设计了如下实验:
请回答下列问题:
(1)写出沉淀中所含物质的化学式: , ①中加入的过量试剂为 .
(2)上述流程中,加入过量稀盐酸的目的是 .
(3)操作Ⅰ、Ⅱ中均需使用的玻璃仪器是 , 该仪器在操作Ⅰ、Ⅱ中的作用分别是:Ⅰ , Ⅱ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原电池产生电流的本质原因是( )
A. 原电池中溶液能电离出自由移动的离子
B. 有两根导线将两个活动性不同的电极连接
C. 电极上进行的氧化还原反应的生成物为电子
D. 电极上进行的氧化还原反应中会有电子的转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)CO2(g)+H2(g)△H>0
试回答下列问题:
(1)请写出该化学反应的平衡常数表达式: .
(2)830K温度下,若起始时c(CO)=2molL﹣1 , c(H2O)=3molL﹣1 , 达到平衡时CO的转化率为50%,则在该温度下,该反应的平衡常数K= .
(3)若降低温度,该反应的K值将 , 该反应的正反应速率将; 该反应的逆反应速率将(均填“增大”“减小”或“不变”).
(4)若要提高CO的转化率,可采取的措施有: .
(5)830K温度下,若起始时c(CO)=1molL﹣1 , c(H2O)=2molL﹣1 , 反应进行一段时间后,测得H2的浓度为0.5molL﹣1 , 则此时该反应是否达到平衡状态(填“是”与“否”),你判断的依据是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列不属于配位化合物的是( )
A.六氟合铝酸钠:Na3[AlF6]
B.氢氧化二氨合银:Ag[NH3]2OH
C.六氟合铁酸钾:K3[FeF6]
D.十二水硫酸铝钾:KAl(SO4)2·12H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置,将溶液A逐滴加入固体B中,下列叙述中不正确的是( ) 
A.若A为浓盐酸,B为MnO2 , C中盛品红溶液,则C中溶液不褪色
B.若A为醋酸溶液,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C.若A为浓硫酸,B为Na2SO3固体,C中盛石蕊溶液,则C中溶液先变红后褪色
D.若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中产生白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】选择合适的分离方法填在横线上。
A.萃取 B.分液 C.蒸馏 D.过滤
(1)分离饱和食盐水与沙子的混合物___。
(2)分离水和汽油的混合物___。
(3)分离四氯化碳(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物___。
(4)从碘的水溶液里提取碘___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com