
【题目】NaCN是重要的基本化工原料,常用于基本化学合成、冶金等,回答下列问题:
(1)NaCN中C的化合价为_____;写出NaCN的电子式:_________________________________;
(2)现代开采金矿:先以NaCN溶液浸取粉碎的含金(Au)矿石,得到 Na[Au(CN)2](二氰合金酸钠)溶液;再用锌与Na[Au(CN)2]溶液发生置换反应生成金。“粉碎”的目的是______________;“浸取”反应的氧化剂是______________;消耗的锌与生成的金的物质的量之比为___________。
(3)工业上常用纯碱、焦炭、氨气反应制备NaCN,写出反应的化学方程式,并用单线桥标明电子转移的方向和数目:____________________________________________。
【答案】+2![]() 增大接触面积,加快反应速率O21∶2
增大接触面积,加快反应速率O21∶2![]() +2NH3===2NaCN+3H2O
+2NH3===2NaCN+3H2O
【解析】
(1)NaCN中钠离子和氢氰根离子之间存在离子键、C-N原子之间存在共价键;(2)矿石粉碎可以增大反应物的接触面积,加快反应速率,根据题给元素化合价的变化可知,NaCN中各元素的化合价没有变,是空气中的氧气氧化了金,根据电子得失守恒可计算出消耗的锌与生成的金的物质的量之比;(3)纯碱、焦炭、氨气反应生成NaCN,该反应中C元素化合价由0价、+4价变为+2价,转移电子数为2。
(1)NaCN中钠元素化合价+1价,氮元素化合价-3价,由化合价代数和为0得关系式:+1+x-3=0,解得x=+2,Na+离子与CN-离子以离子键结合形成离子化合物NaCN,CN-离子中含有碳氮三键,NaCN的电子式为:![]() 。(2)矿石粉碎可以增大反应物的接触面积,加快反应速率;根据题意可知,NaCN溶液与Au以及空气中的氧气反应,Na[Au(CN)2](二氰合金酸钠)溶液,反应的化学方程式为4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH,所以“浸取”反应的氧化剂是氧气,还原得到1mol金要转移1mol电子,1mol锌反应转移2mol电子,所以消耗的锌与生成的金的物质的量之比为1:2。(3)纯碱、焦炭、氨气反应生成NaCN,该反应中C元素化合价由0价、+4价变为+2价,转移电子数为2,电子转移方向和数目为
。(2)矿石粉碎可以增大反应物的接触面积,加快反应速率;根据题意可知,NaCN溶液与Au以及空气中的氧气反应,Na[Au(CN)2](二氰合金酸钠)溶液,反应的化学方程式为4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH,所以“浸取”反应的氧化剂是氧气,还原得到1mol金要转移1mol电子,1mol锌反应转移2mol电子,所以消耗的锌与生成的金的物质的量之比为1:2。(3)纯碱、焦炭、氨气反应生成NaCN,该反应中C元素化合价由0价、+4价变为+2价,转移电子数为2,电子转移方向和数目为![]() +2NH3=2NaCN+3H2O。
+2NH3=2NaCN+3H2O。


科目:高中化学 来源: 题型:
【题目】下列关于Na2CO3和NaHCO3的说法中,不正确的是
A. 焰色反应均为黄色
B. 溶解度:Na2CO3>NaHCO3
C. 可以用加热的方法除去Na2CO3固体中的NaHCO3杂质
D. 物质的量相同的两种固体分别与足量盐酸反应,Na2CO3产生的二氧化碳多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究过氧化钠的强氧化性,某小组设计了如图所示的实验装置。

实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,A中剧烈反应,有黄绿色气体产生。
③待产生连续气泡后,将装置D中的导管末端伸入集气瓶中,收集到无色气体。
④反应一段时间后,关闭分液漏斗的活塞,再通一段时间N2,直至装置中气体变为无色。
回答下列问题:
(1)装置D中收集的无色气体能使带火星的木条复燃,据此推断该气体是_______,解释产生该气体的原因是(用化学方程式表示)____________________________。
(2)装置B中湿润的淀粉碘化钾试纸变蓝。甲同学根据A中气体的颜色推测试纸变蓝时发生的反应可能是(写离子方程式)____________________________;乙同学认为使试纸变蓝的原因也可能是____________________________。
(3)资料显示,Na2O2与干燥的HCl能发生化学反应生成Cl2,该反应的化学方程式为:_________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如下能量关系示意图,下列说法正确的是

A. 1 mol C(g)与1 mol O2(g)的能量之和为393.5 kJ
B. 反应2CO(g)+O2(g) ==2CO2(g)中,生成物的总能量大于反应物的总能量
C. 由C→CO的热化学方程式为:2C(s)+O2(g) ==2CO(g) ΔH= 221.2 kJmol1
D. 热值指一定条件下单位质量的物质完全燃烧所放出热量,则CO热值ΔH= 10.1 kJmol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果.设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示,
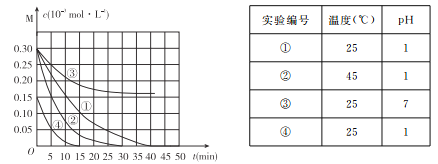
下列说法不正确的是
A. 实验①在15 min内M的降解速率为1.33×10-5mol/(L·min)
B. 若其他条件相同,实验①②说明升高温度,M降解速率增大
C. 若其他条件相同,实验①③证明pH越高,越不利于M的降解
D. 实验④说明M的浓度越小,降解的速率越快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化六氨合钴(Ⅲ)是一种重要的化工产品,实验中采用H2O2作氧化剂,在大量氨和氯化铵存在下,选择活性炭作为催化剂将Co(Ⅱ)氧化为Co(Ⅲ),来制备三氯化六氨合钴(Ⅲ)配合物,反应式为:2(CoCl2·6H2O)+10NH3+2NH4Cl+H2O2![]() 2[Co(NH3)6]Cl3+14H2O
2[Co(NH3)6]Cl3+14H2O

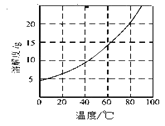
已知:①Co(NH3)6Cl3在不同温度下水中的溶解度曲线如图。
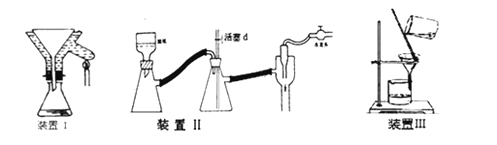
②制备过程中可能用到的部分装置如下:
(1)原料NH4Cl的主要作用是_________;步骤④中要冷却至10℃再加入H2O2溶液,这样操作的目的:_____。
(2)步骤⑤中保持60℃的加热方法是_____,恒温20分钟的目的是_____。
(3)步骤⑥是减压抽滤(见上图装置Ⅱ),当抽滤完毕或中途停止抽滤时,防自来水倒吸入抽滤瓶最佳的正确操作是_____。
(4)操作A的名称为_____。若操作过程中,发现漏斗尖嘴处有少量晶体析出,处理方法是_________。
(5)步骤⑨进行洗涤时要用到两种试剂,应该依次用_____(填序号)洗涤。
A. 饱和氯化钠溶液 B. 无水乙醇 C. 浓盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图所给信息,得出的结论正确的是( )
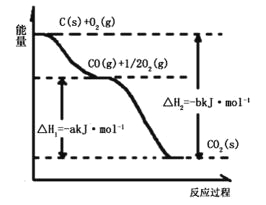
A.碳的燃烧热为bkJ/mol
B.2C(s)+O2(g)=2CO(g)△H=-2(b-a)kJ/mol
C.2CO2(s)=2CO(g)+O2(g)△H=+akJ/mol
D.C(s)+O2(g)=CO2(g)△H<-bkJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某充电宝锂离子电池的总反应为:xLi + Li1-xMn2O4![]() LiMn2O4,某手机镍氢电池总反应为:NiOOH + MH
LiMn2O4,某手机镍氢电池总反应为:NiOOH + MH![]() M+ Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是:
M+ Ni(OH)2(M为储氢金属或合金),有关上述两种电池的说法不正确的是:
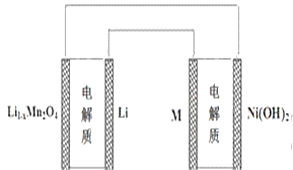
A. 锂离子电池放电时Li+向正极迁移
B. 镍氢电池放电时,正极电极反应式:NiOOH+H2O +e-==Ni(OH)2+OH-
C. 上图表示用锂离子电池给镍氢电池充电
D. 锂离子电池充电时,阴极的电极反应式: LiMn2O4—xe-== Li1-xMn2O4+ xLi+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com