
【题目】下列物质俗名和化学式对应正确的是
A. 石膏 2CaSO4·H2O B. 水玻璃 Na2SiO3
C. 铁红 Fe2O3 D. 明矾 CuSO4·5H2O
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】燃烧法是测定有机物分子式的一种重要方法.某烃蒸汽密度是相同条件下氢气的29倍,完全燃烧5.8g此烃后,测得生成的二氧化碳为8.96L(标准状况),生成的水为9.0g.请通过计算:
(1)推导该烃的分子式.
(2)写出它可能存在的全部结构简式.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏德罗常数,下列叙述正确的是( )
A. 标准状况下,22.4LCCl4含有的分子数为 NA
B. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C. 通常状况下,NA个CO2分子占有的体积为22.4L
D. 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl- 个数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】当乙酸分子中的O都是18O,乙醇分子中的O都是16O,二者在一定条件下反应所生成物中的水的相对分子质量为( )
A.16 B.18 C.20 D.22
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的氧化剂,工业上常用铬铁矿(主要成分为FeO·Cr2O3、SiO2、Al2O3)为原料生产。实验室模拟工业法用铬铁矿制重铬酸钾(K2Cr2O7)的主要工艺如下:
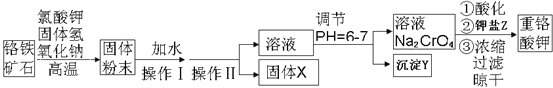
试回答下列问题:
(1)以上工艺流程所涉及元素中属于过渡元素的有_________。铁在周期表的位置是_________。
(2)煅烧前应将铬铁矿充分粉碎,其目的是___________________________。
如在实验室中将铬铁矿和NaOH固体混合物灼烧,从以下各实验仪器中选择必要有_________。
A.陶瓷坩埚 B.铁坩埚 C.三脚架 D.泥三角
(3)操作Ⅱ的名称是__________________。
(4)固体X的主要成分是__________________,沉淀Y的主要成分是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金刚砂(SiC)可由SiO2和碳在一定条件下反应制得,反应方程式为:SiO2+3C ![]() SiC+2CO↑,下列有关说法中正确的是( )
SiC+2CO↑,下列有关说法中正确的是( )
A.该反应中的氧化剂是SiO2 , 还原剂为C
B.该反应中的氧化剂和还原剂的物质的量之比为1:3
C.该反应中每生成1 mol SiC转移4 mol电子
D.该反应中的还原产物是SiC,氧化产物是CO,其物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某汽车安全气囊的产气药剂主要含有NaN3、Fe2O3、KClO4、NaHCO3等物质.当汽车发生碰撞时,产气药剂产生大量气体使气囊迅速膨胀,从而起到保护作用.
(1)NaN3是气体发生剂,受热分解产生N2和Na,N2的结构式为 .
(2)Fe2O3是主氧化剂,与Na反应生成的还原产物为(已知该反应为置换反应),Fe2O3还可用于“铝热法”炼铁,铝热反应在冶金工业上可用于
(3)KClO4是助氧化剂,反应过程中与Na作用生成KCl和Na2O,Na2O的电子式为 .
(4)NaHCO3是冷却剂,吸收产气过程中释放的热量而发生分解,其化学方程式为: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中发生反应:2X(g)+Y(g)![]() aZ(g) △H=QkJ·mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图像,下列有关说法正确的是
aZ(g) △H=QkJ·mol-1,开始按体积比2:1将X、Y充入反应器中,一定条件下发生反应。图甲和图乙是根据反应绘制的图像,下列有关说法正确的是

A. 图甲,P1>P2,a < 3
B. 图甲,T1<T2,Q>0
C. 图乙,t1时表示恒温、恒压条件下,向平衡体系中充入一定量的Z气体
D. 图乙,如果a=3, t2时表示向体系中加入了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属氢氧化物在酸中溶解度不同,因此可以利用这一性质,控制溶液的pH,达到分离金属离子的目的。难溶金属氢氧化物在不同pH下的溶解度[S/(mol·L-1)]如图所示:

难溶金属氢氧化物的S-pH图
(1)pH=3时溶液中铜元素的主要存在形式是___________________________。
(2)若要除去CuCl2溶液中的少量Fe3+,应该控制溶液的pH________。
A.<1 B.4左右 C.>6
(3)在Ni(NO3)2溶液中含有少量的Co2+杂质,________(填“能”或“不能”)通过调节溶液pH的方法来除去,理由是________________________________________。
(4)要使氢氧化铜沉淀溶解,除了加入酸之外,还可以加入氨水生成[Cu(NH3)4]2+,写出反应的离子方程式:_________________________________________________________。
(5)已知一些难溶物的溶度积常数如下表。
物质 | FeS | MnS | CuS | PbS | HgS | ZnS |
Ksp | 6.3×10-18 | 2.5×10-13 | 1.3×10-35 | 3.4×10-28 | 6.4×10-33 | 1.6×10-24 |
为除去某工业废水中含有的Cu2+、Pb2+、Hg2+杂质,最适宜向此工业废水中加入过量的________(填选项)。
A.NaOH B.FeS C.Na2S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com