
【题目】在120℃,101kPa条件下,由H2、CH4、CO组成的混合气体a mL,通入一定量(设为x mL)氧气使其完全燃烧。
(1)若a mL混合气体完全燃烧消耗相同条件下氧气的体积也为a mL(即x=a),则原混合气体中CH4的体积分数是____________。
(2)若完全燃烧后生成CO2和H2O(g)的总体积在相同条件下为2a mL,则原混合气体中CH4的体积分数是__________,现要测定原混合气体中H2的体积分数,还必须知道相同条件下其它数据可以是__________(填选项字母)。
A.前面提供的数据已经足够 B.生成CO2气体的总体积
C.生成H2O(g)的总质量 D.2a mL混合气体的密度
(3)若原混合气体完全燃烧时,生成的气体中只有CO2和H2O(g),求x的取值范围_______。
【答案】33.3%50%B0.5a<x<2a
【解析】
(1)燃烧发生反应:2H2+O2=2H2O(g)、2CO+O2=2CO2、CH4+2O2=CO2+2H2O(g),相同体积的氢气、CO消耗氧气体积相等,假设甲烷为y mL,则氢气、CO总体积为(a-y)mL,根据方程式表示出消耗氧气的体积,进而列方程计算解答;
(2)设H2、CH4、CO的体积分别为zmL、bmL、cmL,根据原子守恒表示出CO2、H2O(g)的体积,再结合总体积列方程解答;结合表达式判断需要知道的数据;
(3)由方程式可知,全部为氢气(或CO)消耗氧气最小,全部为甲烷消耗氧气最多,据此讨论计算解答。
(1)假设甲烷为y mL,则氢气、CO总体积为(a-y)mL,则:
CH4+2 O2=CO2+2H2O(g)
y mL 2y mL
由2H2+O2=2H2O(g)、2CO+O2=2CO2,可知(a-y)mL氢气、CO混合气体消耗氧气为 0.5(a-y)mL,
由题意可知,2ymL+0.5(a-y)mL=amL,
解得y=![]() a,
a,
即甲烷的体积分数为![]() ×100%=33.3%,
×100%=33.3%,
故答案为:33.3%;
(2)设H2、CH4、CO的体积分别为zmL、bmL、cmL,则:z+b+c=a①
根据原子守恒,则:b+c+z+2b=2a②,
联立方程①②,解得b=0.5a,即甲烷的体积分数为![]() ×100%=50%,
×100%=50%,
现要测定原混合气体中H2的体积分数,显然已知质量不能求出,即可排除A、C。若已知生成CO2气体的总体积,根据以上关系即可求出H2的体积分数,故选B,
故答案为:50%;B;
(3)若a mol全部是CO或H2,则完全燃烧时消耗O2的体积为![]() ;若全部是CH4,则完全燃烧时消耗去O2的体积为2 a,所以得0.5a<x<2a。
;若全部是CH4,则完全燃烧时消耗去O2的体积为2 a,所以得0.5a<x<2a。
故答案为:0.5a<x<2a。


科目:高中化学 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是

A. 气态氢化物的稳定性:H2O>NH3>SiH4
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 上图所示实验可证明元素的非金属性:Cl>C>Si
D. 用中文“![]() ”(ào)命名的第118号元素在周期表中位于第七周期0族
”(ào)命名的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常用燃烧的方法测定有机物的的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的的质量确定有机物的组成。下图所示的是用燃烧法确定有机物物分子式的常用装置。
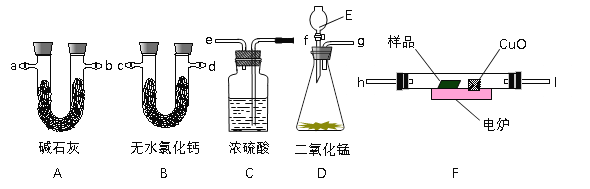
回答下列问题:
(1)用该方法可测定含有哪些元素和什么状态的有机物____________________________;
(2)A、B管内均盛有有固态试剂,B管的作用是_________________________________;
(3)产生的气体由左向右流向,所选用的各导管口连接的顺序是___________________;
(4)E中应盛装什么试剂:_____________________;
(5)如果把CuO网去掉,A管重量将_________;(填“增大”、“减小”、或“不变”)
(6)现准确称取1.8g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,A管增重1.76g,B管增重0.36g,则该有机物的的最简式为_______________;
(7)要确定该有机物的分子式,还必须知道的数据是_____________,可采用的现代物理方法有_________________;
(8)在整个实验开始之前,需先让D产生的气体通过整套装置一段时间,其目的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】长式周期表共有18个纵行,从左到右排为1-18列,碱金属为第1列,稀有气体元素为第18 列。按这种规定,下列说法正确的是
A.第10、11列为ds区B.只有第二列的元素原子最外层电子排布为ns2
C.第四周期第8列是铁元素D.第六周期共包含18种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质,按化合物、单质、混合物的顺序排列的是( )
A.烧碱、液态氧、碘酒B.干冰、铁、冰水混合物
C.生石灰、白磷、熟石灰D.碱石灰、氮气、胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(6分)某有机化合物A的相对分子质量(分子量)大于110,小于150。经分析得知,其中碳和氢的质量分数之和为52.24%,其余为氧。请回答:
(1)该化合物分子中含有几个氧原子,为什么?
(2)该化合物的相对分子质量(分子量)是 。
(3)该化合物的化学式(分子式)是 。
(4)该化合物分子中最多含 个![]() 官能团。
官能团。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393.5kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-571.6kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2599kJ·mol-1
根据盖斯定律,写出298K时由石墨和H2(g)生成乙炔的反应的热化学方程式__________________。
(2)化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知白磷(P4)和P4O6的分子结构如下图所示;现提供以下化学键的键能:P-P 198kJ·mol-1、P-O 360kJ·mol-1、氧气分子内氧原子间的键能为498kJ·mol-1。则P4(s)+ 3O2(g) ==P4O6(s)的反应热H为______。

(3)下图是一个电化学过程的示意图。

请回答下列问题:
①图中甲池是_______(填“原电池”或“电解池”)。
②A(石墨)电极的名称是_______(填“正极”“负极”“阴极”或“阳极”)。
③写出通入CH3OH的电极的电极反应式:__________________。
④乙池中反应的化学方程式为______________________,当乙池中B(Ag)极质量增加5.4 g,甲池中理论上消耗O2的体积为_________L(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com