
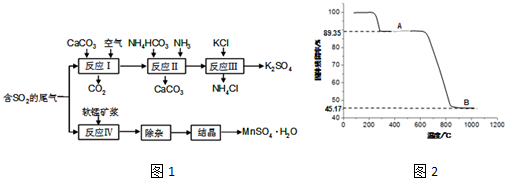
分析 硫酸工业的尾气中含有二氧化硫,反应Ⅰ是用碳酸钙、二氧化硫反应生成亚硫酸钙,再被空气中的氧气氧化成硫酸钙,反应Ⅱ为硫酸钙中加入碳酸铵和氨水,生成碳酸钙沉淀和硫酸铵,反应Ⅲ向(NH4)2SO4溶液中加入KCl溶液充分反应后,进行蒸发浓缩、趁热过滤、洗涤、干燥等操作即得K2SO4产品,反应Ⅳ为二氧化锰氧化二氧化硫得硫酸锰,经除杂结晶得硫酸锰晶体,再经加热可得Mn3O4,
(1)检验氯离子,先加硝酸钡排除硫酸根离子干扰,再利用硝酸银检验;
(2)软锰矿浆主要成分是MnO2,与二氧化硫发生氧化还原反应;
(3)设MnSO4•H2O的物质的量为1 mol,
则m(MnSO4•H2O)=1mol×169g•mol-1=169g,
曲线中B段为锰的氧化物,计算Mn、O的原子个数比确定化学式.
解答 解:(1)检验K2SO4样品是否含有氯化物杂质的实验操作是取少量样品于试管中配成溶液,滴加过量Ba(NO3)2溶液,取上层清液滴加AgNO3溶液,观察是否有白色沉淀可确定,
故答案为:取少量样品于试管中配成溶液,滴加过量Ba(NO3)2溶液,取上层清液滴加AgNO3溶液;
(2)软锰矿浆主要成分是MnO2,与二氧化硫发生氧化还原反应,则反应IV的化学方程式为MnO2+SO2=MnSO4,
故答案为:MnO2+SO2=MnSO4;
(3)设MnSO4•H2O的物质的量为1 mol,
则m(MnSO4•H2O)=1mol×169g•mol-1=169g,
曲线中B段为锰的氧化物,其质量为m(氧化物)=169 g×0.4517=76.34g,
其中n(Mn)=1mol,m(Mn)=1mol×55g•mol-1=55g,
则n(O)=$\frac{76.34g-55g}{16g/mol}$,
n(Mn):n(O)=1 mol:$\frac{4}{3}$mol=3:4,
因此B段所表示物质的化学式为Mn3O4,
答:因此B段所表示物质的化学式为Mn3O4.
点评 本题考查物质的制备实验,为高频考点,把握离子检验、氧化还原反应、溶度积计算等为解答的关键,侧重分析与实验、计算能力的考查,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 在有AgCl沉淀的溶液中加入NaC1固体,c(Ag+)减小 | |
| B. | 室温下100mL pH=1.3的Ba(OH)2溶液中OH-的物质的量为0.02 mol | |
| C. | 稀释0.1 mol/L的NH3•H2O溶液,溶液中所有离子浓度均减小 | |
| D. | 溶液中水电离出c(H+)和水电离出的c(OH-)的乘积一定等于10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 起始物质的量浓度(mol/L) | 1.5 | 1 | 0 |
| 2s末物质的量浓度(mol/L) | 0.9 | 0.8 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知反应:3I-(aq)+S2O82-(aq)═I3-(aq)+2SO42-(aq)+Q
已知反应:3I-(aq)+S2O82-(aq)═I3-(aq)+2SO42-(aq)+Q| 实验编号 | ① | ② | ③ | ④ | ⑤ |
| c(I-)/mol•L-1 | 0.040 | 0.080 | 0.080 | 0.160 | 0.160 |
| c(S2O82-)/mol•L-1 | 0.040 | 0.040 | 0.080 | 0.080 | 0.040 |
| t/s | 88 | 44 | 22 | 11 | t1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烷光照下能与浓盐酸发生取代反应 | |
| B. | 乙烯可以用作生产食品包装材料的原料 | |
| C. | 乙醇室温下在水中的溶解度大于溴乙烷 | |
| D. | 乙酸和甲酸甲酯互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com