
【题目】常温下,物质的量浓度均为0.1mol·L-1的下列四种溶液,其中pH最小的是( )
A.NaCl B.Ba(OH)2 C.NH4Al(SO4)2 D.Na3PO4
 春雨教育同步作文系列答案
春雨教育同步作文系列答案科目:高中化学 来源: 题型:
【题目】下列有关化学用语表示正确的是( )
A.丙烯的结构简式:C3H6
B.氢氧根离子的电子式: ![]()
C.氯原子的结构示意图:![]()
D.中子数为146、质子数为92 的铀(U)原子![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据图回答下列问题:
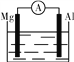
①
(1)如图①,若烧杯中溶液为稀硫酸,则观察到的现象是
________________________________________________________________________;
若烧杯中溶液为氢氧化钠溶液,则负极的电极反应式为____________________。
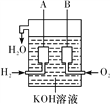
②
(2)美国阿波罗宇宙飞船上使用了一种新型装置,其构造如图②所示:A、B两个电极均由多孔的碳块组成。该电池的正极为________(填“A”或“B”);
如果将图②装置中通入的H2改成CH4气体也可以组成一个原电池装置电池的总反应方程式为CH4+2O2+2KOH===K2CO3+3H2O,则该电池的负极反应式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组,通过下图装置进行硫酸与铜反应的实验探究。
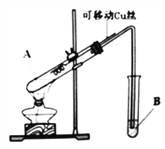
⑴提出假设:
假设一:加热时,稀H2SO4与Cu能反应。
假设二:加热时,浓H2SO4与Cu能反应。
⑵设计实验:
实验编号 | 实验操作 | 实验现象 |
1 | 将Cu丝与稀H2SO4接触,加热 | 试管B中溶液无明显变化 |
2 | 将Cu丝与浓H2SO4接触,加热 | 试管B中溶液褪色 |
实验前,试管B盛放的是_______________溶液(填“品红”或“酚酞”)。
⑶实验结论:通过以上实验,说明浓硫酸具有____________________(填写字母代号)。
A.强氧化性 B.脱水性 C.吸水性
⑷问题与计论:
①有同学认为该装置不完善,Cu与浓H2SO4反应生成了一种大气污染物,该气体是________;他建议在试管B口塞一团棉花,该棉花最好浸泡下列哪种溶液__________(填字母编号);
A.稀盐酸 B.NaOH溶液 C.NaCl溶液
②该兴趣小组在探究Cu与浓H2SO4反应时,将质量5.0g可移动Cu丝部分伸入浓H2SO4中,充分反应后,Cu丝剩余3.4g,将试管A中液体稀释成100ml溶液。该溶液中Cu2+物质的量浓度为_____mol·L-1 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备硫酸常用接触法,工业上制硝酸常用氨的催化氧化法。下列关于工业上制硫酸与硝酸的说法中不正确的是( )
A. 在沸腾炉中进行的反应为:4FeS2+11O2![]() 2Fe2O3+8SO2
2Fe2O3+8SO2
B. 制硫酸在吸收塔中是用水来吸收SO3
C. 氨催化氧化制硝酸过程中的三个主要反应都属于氧化还原反应
D. 硫酸工业、硝酸工业都需要对工业尾气进行处理
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)是重要的漂白剂。某小组开展如下实验,按如图装置制取无水NaClO2晶体,回答下列问题:
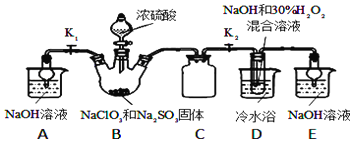
已知:NaClO2饱和溶液在低于38℃时析出NaClO23H2O,高于38℃时析出NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl.
(1)装置C的作用是_________________;
(2)已知装置B中的产物有ClO2气体,则B中反应的方程式为_________________;装置D中反应生成NaClO2的化学方程式为_________________________;
(3)从装置D反应后的溶液中获得无水NaClO2晶体的操作步骤为:①减压,55℃蒸发结晶;②____________;③用38℃~60℃热水________;④在_____________条件下干燥得到成品.
(4)如果撤去D中的冷水浴,可能导致产品中混有的杂质是_________和____________;
(5)测定样品中NaClO2的纯度.测定时进行如下实验:
准确称一定质量的样品,加入适量蒸馏水和过量的KI晶体,在酸性条件下发生如下反应:ClO2-+4I-+4H+═2H2O+2I2+Cl-,将所得混合液稀释成100mL待测溶液.取25.00mL待测溶液,加入淀粉溶液做指示剂,用c molL-1 Na2S2O3标准液滴定至终点,测得消耗标准溶液体积的平均值为V mL(已知:I2+2S2O32-═2I-+S4O62-).请计算所称取的样品中NaClO2的物质的量为__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识判断以下观点不正确的是
①放热反应不需要任何条件就能进行 ②原电池装置中化学能转化为电能 ③原电池工作时发生的反应一定是氧化还原反应 ④加热时化学反应速率增大 ⑤化学反应达到平衡时反应不再进行
A. ①②④ B. ①⑤ C. ②③⑤ D. ①④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下向10mLpH=3的醋酸溶液中加入水稀释后,下列说法正确是的
A.溶液中导电粒子的数目减少
B.溶液中![]() 不变
不变
C.醋酸的电离程度增大,c(H+)亦增大
D.再加入10mLpH=11的NaOH溶液,混合液的pH=7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com