
分析 (1)阴极增重既是Cu质量,计算铜物质的量和加入硫酸铜晶体所含铜离子物质的量比较判断电解过程中,硫酸铜过量,依据电极反应过程中电子守恒计算阳极生成的气体物质的量,得到气体体积;
(2)计算电解的硫酸铜溶液生成铜和放出氧气质量得到剩余溶液质量,结合电解过程计算剩余硫酸铜质量,根据c=$\frac{n}{V}$进行计算.
解答 解::(1)阴极增重是Cu的质量,物质的量=$\frac{0.25g}{64g/mol}$=0.004mol,5.0g胆矾晶体(CuSO4.5H2O)物质的量=$\frac{5.0g}{250g/mol}$=0.02mol.所以硫酸铜剩余,阳极只能产生O2,依据电子守恒,生成氧气与Cu等电子量=0.008mol,故氧气为$\frac{0.008mol}{4}$=0.002mol标准状况阳极气体体积=0.002mol×22.4L/mol=0.0448L=44.8ml,
答:阳极上一共产生了气体体积为44.8mL;
(2)硫酸铜剩余0.016mol,和0.004mol的硫酸,所以电解后的硫酸铜的物质的量浓度为:$\frac{0.016mol}{0.1L}$=0.16mol/L,硫酸的物质的量浓度为:$\frac{0.004mol}{0.1L}$=0.04mol/L,答:电解后溶质硫酸铜和硫酸的物质的量浓度分别为:0.16mol/L;0.04mol/L.
点评 本题考查了电解原理的分析应用,电极反应和电子守恒的计算分析,掌握基础是关键,题目难度中等.


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 简单离子半径:W>Z | |
| B. | X和W形成的化合物属于离子化合物 | |
| C. | 由X、Y、Z三种元素组成化合物的水溶液一定显酸性 | |
| D. | Z最简单氢化物分子间存在氢键,故其稳定性强于Y最简单氢化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 燃烧法是测定有机化合物化学式的一种重要方法.现完全燃烧一定质量的某烃,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重3.6g,乙装置增重8.8g,又知该烃的蒸汽密度是同温同压下氢气密度的28倍.
燃烧法是测定有机化合物化学式的一种重要方法.现完全燃烧一定质量的某烃,燃烧产物依次通过如图所示的装置,实验结束后,称得甲装置增重3.6g,乙装置增重8.8g,又知该烃的蒸汽密度是同温同压下氢气密度的28倍.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
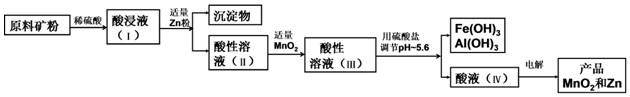
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V(N2)=0.2 mol•L-1•min-1 | B. | V(H2)=0.1 mol•L-1•min-1 | ||
| C. | V(NH3)=0.15 mol•L-1•min-1 | D. | V(H2)=0.4 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
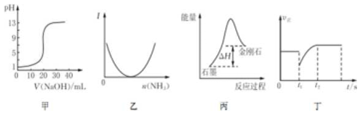
| A. | 图甲表示0.10mol•L-1NaOH溶液滴定20.00 mL 0.10 mol•L-1醋酸溶液的滴定曲线 | |
| B. | 图乙表示向乙酸溶液中通入氨气至过量过程中溶液导电性I的变化 | |
| C. | 根据图丙所示可知:石墨转化为金刚石吸收热量,石墨比金刚石稳定 | |
| D. | 图丁表示反应2SO2+O2?2SO3,t1时刻只减小了 SO3的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
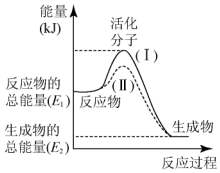 在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察图,然后回答下列问题:
在化学反应中,只有极少数能量比平均能量高得多的反应物分子发生碰撞时才可能发生化学反应,这些分子被称为活化分子.使普通分子变成活化分子所需提供的最低限度的能量叫活化能,其单位通常用kJ•mol-1表示.请认真观察图,然后回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
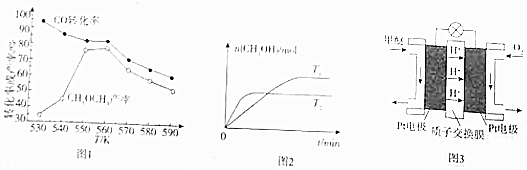
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com