
| A. | 上层液体呈紫红色 | B. | 下层液体呈褐色 | ||
| C. | 上层液体呈深褐色 | D. | 下层液体呈紫红色 |
科目:高中化学 来源: 题型:选择题
| A. | .①②②③ | B. | ②③②① | C. | ②①②③ | D. | ①①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
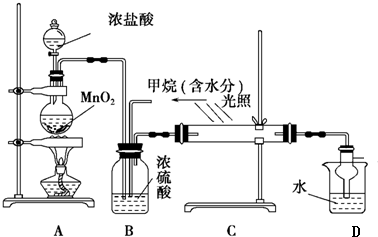
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与H2O反应制备O2:Na2O2+H2O═2Na++2OH-+O2↑ | |
| B. | 硅与NaOH溶液的反应:Si+2OH-+H2O═SiO32-+2H2↑ | |
| C. | 硫酸与Ba(OH)2溶液反应:Ba2++OH-+H++SO42-═BaSO4↓+H2O | |
| D. | 氯气溶于水的反应:Cl2+H2O═2H++Cl-+ClO- |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验原理 | m=cVM |
| 实验仪器 | 托盘天平、药匙、烧杯、玻璃棒、100ml容量瓶、胶头滴管 |
| 实验步骤 | (1)计算:溶质NaCl固体的质量为11.7g. (2)称量:用托盘天平称取所需NaCl固体. (3)溶解:将称好的NaCl固体放入烧杯中,用适量蒸馏水溶解. (4)转移、洗涤:将烧杯中的溶液注入仪器①中,并用少量蒸馏水洗涤烧杯内壁2~3次,洗涤液也都注入仪器①中. (5)定容将蒸馏水注入仪器至液面离刻度线1~2cm时,改用胶头滴管滴加蒸馏水至液面与刻度线相切. (6)摇匀:盖好瓶塞,反复上下颠倒,然后静置. |
| 思考与探究 | (1)实验步骤(3)、(4)中都要用到玻璃棒,其作用分别是搅拌、 引流 (2)某同学在实验步骤(6)后,发现凹液面低于刻度线,于是再向容器中滴加蒸馏水至刻度线,该同学所配置溶液是浓度< (填“>”、“=”或“<”)2.00mol/L. |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com