
| A. | Fe2+、Cl-、NO3-、K+ | B. | K+、Mg2+、Cl-、SO42- | ||
| C. | Na+、Br-、NO3-、S2- | D. | K+、CO32-、Na+、AlO2- |
分析 能与铝片反应产生氢气的溶液中存在大量氢离子或氢氧根离子,
A.酸性条件下硝酸根离子能够氧化亚铁离子,亚铁离子与氢氧根离子反应;
B.酸性条件下,四种离子之间不反应,都不与氢离子反应;
C.四种离子之间不反应,都不与氢氧根离子反应;
D.四种离子之间不反应,都不与氢氧根离子反应.
解答 解:能与铝片反应产生氢气的溶液呈酸性或强碱性,溶液中存在大量氢离子或氢氧根离子,
A.Fe2+与氢氧根离子反应,Fe2+、NO3-在酸性条件下发生氧化还原反应,在溶液中一定不能大量共存,故A正确;
B.K+、Mg2+、Cl-、SO42-之间不发生反应,都不与氢离子反应,在酸性条件下能够大量共存,故B错误;
C.Na+、Br-、NO3-、S2-之间不反应,都不与氢氧根离子反应,在碱性溶液中可以大量共存,故C错误;
D.K+、CO32-、Na+、AlO2-之间不发生反应,都不与氢氧根离子反应,在碱性溶液中可以大量共存,故D错误;
故选A.
点评 本题考查离子共存,为高考的高频题,题目难度不大,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;还应该注意溶液的具体反应条件“能与铝片反应产生氢气,该溶液中一定不能大量共存的离子”,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| 物质 项目 | 乙炔水化法 | 乙烯氧化法 |
| 原料 | 乙炔、水 | 乙烯、空气 |
| 反应条件 | HgSO4(催化剂) 100℃~125℃ | PdCl2~CuCl2(催化剂) 100℃~125℃ |
| 平衡转化率 | 乙炔转化率 90% | 乙烯转化率 80% |
| 反应速率 | 较 慢 | 较 快 |
| 原料来源生产工艺 | CaCO3$\stackrel{高温}{→}$CaO$\stackrel{+C电炉}{→}$ CaC2$\stackrel{饱和食盐水}{→}$C2H2 | 石油裂解气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1 NH3•H2O溶液与0.1 mol•L-1盐酸等体积混合:c(NH4+)>c(Cl-)>c(OH-)>c(H+) | |
| B. | 0.1 mol•L-1 NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3) | |
| C. | 向0.2 mol•L-1 NaHCO3溶液中加入等体积的 0.1 mol•L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| D. | 0.1 mol•L-1 Na2CO3溶液:c(HCO3-)+c(H2CO3)=c(OH-)-c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其原子核内中子数和质子数都是m | |
| B. | 其原子核内中子数为( n-m )个,核外电子数肯定为n个 | |
| C. | 其原子质量与12C原子质量之比约为n:12 | |
| D. | 其原子质量是12C原子质量的n倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
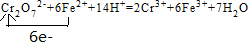 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂水解可得到氨基酸和甘油 | |
| B. | 甲醇、乙二醇、丙三醇都为饱和醇,熔沸点依次递增 | |
| C. | 甘氨酸H2N-CH2COOH、丙氨酸CH3CH(NH2)COOH、谷氨酸HOOCCH2CH2CH(NH2)COOH 一定条件下形成链状三肽的结构最多有2×33种 | |
| D. | 分子式为C5H10O2的所有酯类的同分异构体共有9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 烷烃的同系物的分子式可用通式CnH2n+2表示 | |
| B. | 同系物间具有相似的结构 | |
| C. | 两个同系物之间的相对分子质量差为14或14的整数倍 | |
| D. | 甲烷不是乙炔的同系物,但乙烯是乙炔的同系物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:HX<H2Y<ZH3 | |
| B. | 非金属活泼性:Y<X<Z | |
| C. | 原子半径:X>Y>Z | |
| D. | 原子最外电子层上电子数的关系:Y=$\frac{1}{2}$(X+Z) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com