

| A. | 摩尔质量为313.5 g | B. | 属于芳香烃 | ||
| C. | 分子式为C12H19Cl3N2O | D. | 不能发生加成反应 |
科目:高中化学 来源: 题型:解答题
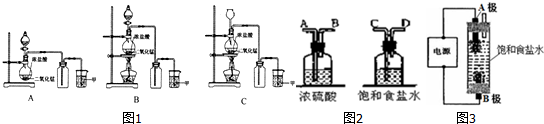
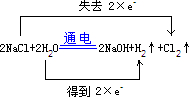 .有人用图3所示装置制取消毒液(主要成分为NaClO),其中A极为阴极,B极为阳极,则阳极的产物为Cl2(填化学式).
.有人用图3所示装置制取消毒液(主要成分为NaClO),其中A极为阴极,B极为阳极,则阳极的产物为Cl2(填化学式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等 | |
| B. | 铅蓄电池放电时的负极和充电时的阴极均发生氧化反应 | |
| C. | 氢氧燃料电池的能量转换形式之一为化学能转化为电能 | |
| D. | 催化剂通过降低化学反应的焓变加快化学反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| B. | 加入氢氧化钠溶液,先产生白色沉淀,后迅速变为灰绿色,最后变为红褐色,一定有Fe2+ | |
| C. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| D. | 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有Ba2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.
 ,则氨气的平衡转化率是75%.
,则氨气的平衡转化率是75%.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO是弱酸,所以NaClO是弱电解质 | |
| B. | 向氯化铁溶液中加入NaOH溶液,可制得Fe(OH)3胶体 | |
| C. | 固体的NaCl不导电,熔融态的NaCl可以导电 | |
| D. | 在河流入海口处易形成三角洲原理与胶体的性质无关 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的化学方程式及室温下的平衡常数如下:
烟气(主要污染物SO2、NOx)经O3预处理后用CaSO3水悬浮液吸收,可减少烟气中SO2、NOx的含量.O3氧化烟气中SO2、NOx的主要反应的化学方程式及室温下的平衡常数如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

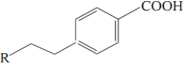
 ),M的一种合成路线如图(部分反应试剂和条件省略).
),M的一种合成路线如图(部分反应试剂和条件省略).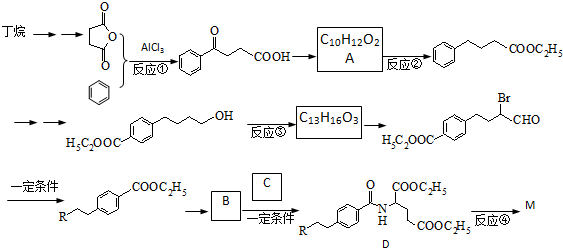
 ,C
,C ;
;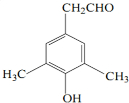 或
或
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150 mL 1 mol•L-1Na3PO4溶液 | B. | 75 mL 2 mol•L-1NaNO3溶液 | ||
| C. | 75 mL 3 mol•L-1Na2SO4溶液 | D. | 150 mL 2mol•L-1 CH3COONa溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com