
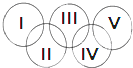
 如右图,假定五环中的一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应,且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )
如右图,假定五环中的一环表示一种物质,相连环物质间一定条件下能发生常见反应,不相连环物质间不能发生反应,且四种反应中必须包含化合反应、置换反应及复分解反应,适合的一组是( )| Ⅰ | Ⅱ | Ⅲ | Ⅳ | Ⅴ | |
| A | SiO2 | NaOH溶液 | CuSO4溶液 | Ag | O2 |
| B | O2 | Fe | 稀H2SO4 | NaOH溶液 | CO2 |
| C | O2 | NH3 | 稀H2SO4 | NaOH溶液 | Al |
| D | Mg | Al | CO2 | Fe2O3 | KOH溶液 |
| A、A | B、B | C、C | D、D |
| ||
| ||
| ||


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:Na>O;离子半径:Na+<O2- |
| B、第ⅦA族元素碘的两种核素131I和137I的核外电子数之差为6 |
| C、P和As属于第VA族元素,H3PO4的酸性强于H3AsO4的酸性 |
| D、Na、Mg、Al三种元素最高价氧化物对应水化物的碱性均依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、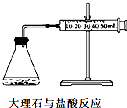 可以测量大理石与盐酸的反应速率 |
B、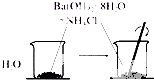 说明吸热反应也可能是自发反应 |
C、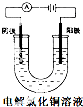 两个电极都为铜片时,电解初期溶液的浓度基本不改变 |
D、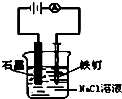 实验中,铁钉上会有刺激性气体产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2 L氦气中含有0.5 NA原子 |
| B、常温常压下,46g NO2和N2O4混合气体中含有原子总数为3NA |
| C、标准状况下,0.1 mol Cl2参加反应,转移的电子数目一定为0.2 NA |
| D、1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,转移电子总数NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向AlCl3溶液滴入过量氨水:Al3++4OH-=AlO2-+2H2O | ||
B、用银氨溶液检验乙醛中的醛基:CH3CHO+2Ag(NH3)2++2OH-
| ||
| C、苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+2CO32- | ||
| D、Na2SO3溶液使酸性KMnO4溶液褪色:5SO32-+4H++2MnO4-=5SO42-+2Mn2++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
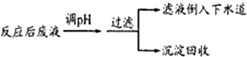
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(H+):c(OH-)=1:2的溶液:K+、Al3+、HCO3-、ClO- |
| B、与Al反应生成H2的溶液:Na+、Ba2+、NO3-、Cl- |
| C、中性溶液中:SO32-、S2-、Fe3+、Cl- |
| D、能使红色酚酞变无色的溶液:K+、Ca2+、Cl-、HCO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com