
【化学选修-有机化学基础】(15分)以烯烃为原料,合成某些高聚物的路线如下:
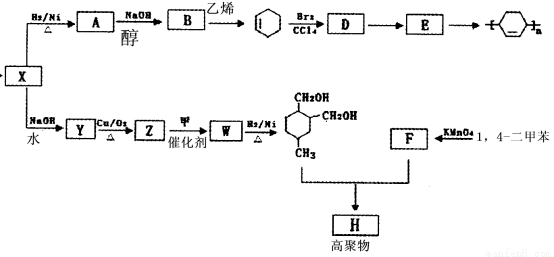
已知: (或写成
(或写成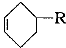 )
)
⑴CH3CH=CHCH3的名称是____________。⑵X中含有的官能团是______________。
⑶A→B的化学方程式是_____________。⑷D→E的反应类型是_______________。
⑸甲为烃,F能与NaHCO3反应产生CO2。
①下列有关说法正确的是_______________。
a.有机物Z能发生银镜反应 b.有机物Y与HOCH2CH2OH互为同系物
c.有机物Y的沸点比B低 d.有机物F能与己二胺缩聚成聚合物
②Y的同分异构体有多种,写出分子结构中含有酯基的所有同分异构体的种类数__ ___。
③Z→W的化学方程式是__________________。
⑹高聚物H的结构简式是_________________。
(1)2-丁烯;
(2)碳碳双键、氯原子;
 (3)ClCH2CH2CH2CH2Cl+2NaOH CH2=CH-CH=CH2+2NaCl+2H2O;
(3)ClCH2CH2CH2CH2Cl+2NaOH CH2=CH-CH=CH2+2NaCl+2H2O;
(4)消去反应;
(5)①ad;② 4③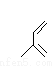 +
+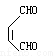 →
→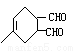
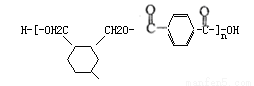
(6)
【解析】
试题分析:(1)根据烯烃的命名CH3CH=CHCH3的名称是2-丁烯;
(2)由E的产物的结构简式倒推出E为1,3-环己二烯,B为1,3-丁二烯,所以A为1,4-二卤代烃,A是X的加氢产物,所以X中存在碳碳双键、氯原子;
 (3)A→B发生卤代烃的消去反应生成烯烃,化学方程式为
(3)A→B发生卤代烃的消去反应生成烯烃,化学方程式为
 ClCH2CH2CH2CH2Cl+2NaOH CH2=CH-CH=CH2+2NaCl+2H2O;
ClCH2CH2CH2CH2Cl+2NaOH CH2=CH-CH=CH2+2NaCl+2H2O;
(4)D中有2个溴原子,E为1,3-环己二烯,所以D到E发生消去反应;
(5)①1,4-二甲苯被酸性高锰酸钾氧化生成F是对苯二甲酸,a、A中的Cl原子在碳链的端位,所以水解得Y中存在-CH2OH结构, Y发生催化氧化生成Z中存在醛基,能发生银镜反应,正确;b、Y中含有2个羟基和1个碳碳双键,与HOCH2CH2OH不是同系物,错误;c、Y是含碳碳双键的醇类,B为烯烃,所以Y的沸点高,错误;d、有机物F是对苯二甲酸,能与己二胺缩聚成聚合物多肽或蛋白质,正确,答案选ad;
②Y中含有2个羟基和1个碳碳双键,所以Y的含有酯基的所有同分异构体共4种,分别是甲酸丙酯、甲酸异丙酯、乙酸乙酯、丙酸甲酯;
③由以上分析知Z是 ,根据W的加氢产物判断甲为
,根据W的加氢产物判断甲为 ,所以Z→W发生类似已知的反应,化学方程式是
,所以Z→W发生类似已知的反应,化学方程式是 +
+ →
→
(6)H是对二苯甲酸与W的加氢产物发生缩聚反应的产物,所以H的结构简式为
考点:考查有机推断,有机物的命名,官能团的判断,反应类型的判断,化学方程式、结构简式的书写,同分异构体的判断


科目:高中化学 来源:2013-2014江西省鹰潭市下学期期末质量检测高二化学试卷(解析版) 题型:选择题
用高铁酸钠(Na2FeO4)对河湖水消毒是城市饮用水处理的新技术。已知反应
Fe2O3+3Na2O2===2Na2FeO4+Na2O,下列说法正确的是( )
A.Na2O2既是氧化剂又是还原剂
B.Fe2O3在反应中得到电子
C.3 mol Na2O2发生反应,有12 mol e-发生转移
D.Na2FeO4能消毒杀菌是因其具有强氧化性
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省高三4月联考理综化学试卷(解析版) 题型:选择题
下列除杂,所用试剂和操作均正确的是
选项 | 物质成分(括号内为杂质) | 所用试剂 | 操作 |
A | 铁屑(油污) | 纯碱溶液 | 洗涤 |
B | 苯(苯酚) | 溴水 | 过滤 |
C | 碳酸钡(硫酸钡) | 盐酸 | 溶解、过滤 |
D | 乙醇(乙酸) | 烧碱溶液 | 分液 |
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省协作体高三第二次联考理综化学试卷(解析版) 题型:填空题
【化学—物质结构与性质】(15分)
许多金属及它们的化合物在科学研究和工业生产中具有许多用途.回答下列有关问题:
(1)基态Ni核外电子排布式为________________, 第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是________________;
(2)①已知CrO5中Cr为+6价,则CrO5的结构式为 。
②金属镍粉在CO气流中轻微加热,生成无色挥发性液体Ni(CO)n ,与Ni(CO)n中配体
互为等电子体的离子的化学式为 (写出一个即可)。
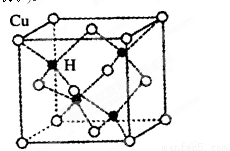
③铜是第四周期最重要的过渡元素之一,其单质及化合物有广泛用途。已知CuH晶
体结构单元如图所示。该化合物的的密度为ρg/cm3,阿伏加德罗常数的值为NA,则
该晶胞中Cu原子与H原子之间的最短距离为 cm(用含ρ和NA的式子表示)。
(3)另一种铜金合金晶体具有面心立方最密堆积的结构,在晶胞中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为__________,若该晶胞的边长为a pm,则合金的密度为_________ g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省协作体高三第二次联考理综化学试卷(解析版) 题型:选择题
用酸性氢氧燃料电池为电源进行电解的实验装置如下图所示。下列说法正确的是( )
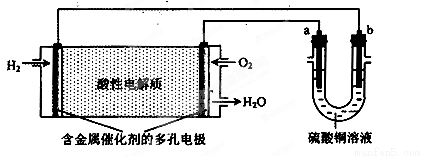
A. a为负极,b为正极
B.若a极是铁,b极是铜,b极逐渐溶解,a极上有铜析出
C.若a、b极都是石墨,在相同条件下,理论上a极产生的气体与电池中消耗的O2体积相等
D.若电解精炼粗铜时,b极是粗铜,a极是纯铜
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省抚州五校高三5月联考理综化学试卷(解析版) 题型:填空题
(14分)(Ⅰ)、A、B、C、D、E、五种元素均是短周期元素,且原子序数依次增大。B、E原子的最外层电子数均为其电子层数的2倍。D、E元素原子的最外层电子数相等。X、Y、Z、W、G、甲、乙七种物质均由上述中的两种或三种元素组成。元素B形成的单质M与甲、乙(相对分子质量:甲<乙)浓溶液的反应分别是:甲与M反应生成X、Y、Z,乙与M反应生成Y、Z、W,反应条件均省略。回答下列有关问题:
⑴X、Y、W均能与Z反应,若将标准状况下的X和D2按4:1充满试管后将其倒立于水槽中,待水不在上升时,试管内溶质的物质的量浓度是 (假设溶质不扩散)
⑵若将X、W、D2按4:4:3通入Z中充分反应,写出总的离子方程式
⑶G是一种既能与强酸又能与强碱反应的酸式盐,则G的电子式 ,取0.2mol/L的NaOH溶液与0.1mol/L的G溶液等体积混合后,加热至充分反应后,待恢复至室温剩余溶液中离子浓度的由大到小顺序是 ,此时测得溶液的PH=12,则此条件下G中阴离子的电离平衡常数Ka =
(Ⅱ)⑷某温度时,向AgNO3溶液中加入K2CrO4溶液会生成
Ag2CrO4沉淀,Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。
该温度下,下列说法正确的是_________。

A. Ag2CrO4的溶度积常数(Ksp)为1×10-8
B. 含有大量CrO 的溶液中一定不存在Ag+
的溶液中一定不存在Ag+
C. a点表示Ag2CrO4的不饱和溶液,蒸发可以使溶液由a点变到b点
D. 0.02mol·L-1的AgNO3溶液与0.02mol·L-1的Na2CrO4溶液等体积混合会生成沉淀
⑸若常温下Ksp[Cr(OH)3]=10-32,要使c(Cr3+)降至10-5mol·L-1,溶液的pH应调至_______。
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省抚州五校高三5月联考理综化学试卷(解析版) 题型:选择题
下列说法不正确的是( )
A.煤经过气化和液化等物理变化可以转化为清洁燃料
B.侯氏制碱法的工艺过程,应用了物质溶解度的差异
C.食品包装中常见的脱氧剂组成为还原性铁粉、氯化钠、炭粉等,其脱氧原理与钢铁的吸氧腐蚀相同
D.甘氨酸和丙氨酸发生脱水反应,最多可生成4种二肽
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省南昌市高二下学期期末考试化学试卷(解析版) 题型:填空题
(8分)某液体化合物X2Y4,常用做火箭燃料。16g X2Y4在一定量的O2中恰好完全燃烧,反应方程式为X2Y4(l)+O2(g)===X2(g)+2Y2O(l)。冷却后标准状况下测得生成物的体积为11.2 L,其密度为1.25g/L,则:
(1)反应前O2的体积V(O2)为________。
(2)X2的摩尔质量为________;Y元素的名称是________。
(3)若反应生成0.1mol X2,则转移电子的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源:2013-2014江西省高二下学期期末考试化学试卷(解析版) 题型:填空题
(12分)卤化物和卤酸盐在工业生产中有着重要的作用。某小组为探究其中一些盐的性质,查阅资料并进行实验。
查阅资料如下:
①BrO3-+ 6I-+ 6H+ = 3I2 + Br-+ 3H2O ② 2BrO3-+ I2 = 2IO3-+ Br2
③ IO3-+ 5I-+ 6H+ = 3I2 + 3H2O ④ 2IO3-+ 10Br-+ 12H+ = I2 + 5Br2 + 6H2O
实验如下:
步 骤 | 现 象 |
ⅰ.向盛有30 mL 0.2 mol·L-1 KI溶液的锥形瓶中依次滴入几滴淀粉溶液和足量稀硫酸,再用滴定管逐滴加入KBrO3溶液 | 随着KBrO3溶液滴入,溶液由无色变为蓝色并逐渐加深,最终保持不变 |
ⅱ.继续向上述溶液中滴入KBrO3溶液 | 溶液的蓝色逐渐褪去 |
 请回答:
请回答:
(1)步骤ⅰ开始时发生的反应如资料①所示,溶液中I-完全被氧化时转移 mol e-,该反应中硫酸表现出的化学性质是 。
(2)上述资料中的反应 (填序号)可表示步骤ⅱ中的反应,通过该反应 (填“能”或“不能”)说明碘的非金属性强于溴,原因是 。
(3)根据资料中的反应①~④并结合所学知识,判断IO3-、BrO3-、I2、Br2的氧化性由强到弱的顺序是 ;KBrO3溶液与KBr溶液在酸性条件下反应的离子方程式是 。
(4)若用y表示锥形瓶中含碘物质的物质的量,用x表示所滴入KBrO3的物质的量,在下图中画出上述整个实验过程中y随x的变化曲线(要求:在图中标出终点坐标)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com