


 快捷英语周周练系列答案
快捷英语周周练系列答案科目:高中化学 来源: 题型:
| ||
| pH试纸 |
| ②加入足量氯水 |
| 同时加入氯化钡溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7D | B、5D | C、3D | D、2D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯水化制得乙醇 |
| B、甲烷与绿气制备一氯甲烷 |
| C、铜和浓硝酸为原料生产硝酸铜 |
| D、乙酸与乙醇制乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
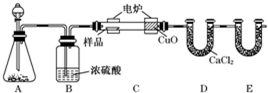
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据实验④可推出溶液中不存在NO2-与SO32- |
| B、该溶液中一定含有NO3-、SO42-、NH4+ |
| C、往一定量该溶液中加入足量Ba(NO3)2溶液,静置后往上层清液中滴加硝酸酸化的AgNO3溶液,若有白色沉淀生成,说明溶液中含有Cl- |
| D、根据实验①可推出溶液中含有NO3-或NO2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 氧化物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 4.2 |
| 沉淀完全的pH | 3.7 | 9.7 | 6.7 |
| 1 |
| 2 |
| 3 |
| 2 |
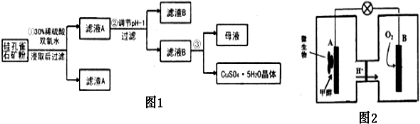
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com